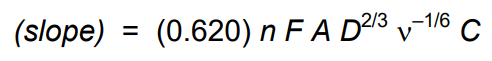گزارش کار آزمایشگاه شیمی تجزیه 2 :بررسی سه روش ولتامتری
- شرح هدف: این آزمایش سه روش مختلف ولتامتری را در محلول آنالیت یکسان مقایسه می کند. روش های مورد مطالعه ولتامتری چرخه ای، ولتامتری دیسک چرخشی و کرونوآمپرومتری می باشد. و ضمن آموزش شیمی تجزیه 2 و یادآوری معادلات لویچ، رندلز و کاترل، ضریب انتشار آنالیت در هر روش تعیین می شود.
ولتامتری در شیمی تجزیه 2
ولتامتری، تکنیک الکتروشیمیایی است که پتانسیل یک الکترود را کنترل و همزمان جریان در آن الکترود را اندازهگیری می کند. الکترود مورد نظر معمولاً به عنوان الکترود کار نامیده می شود تا از سایر الکترودهای موجود در سلول الکتروشیمیایی متمایز شوذ.
ولتامتری معمولاً با اتصال یک پتانسیواستات الکتروشیمیایی به یک سلول الکتروشیمیایی انجام می شود.
سلول حاوی یک محلول آزمایشی و سه الکترود است:
-
کار،
-
مرجع
-
کمکی.
مدارهای الکترونیکی ویژه در پتانسیواستات اجازه می دهد تا پتانسیل الکترود کار با توجه به الکترود مرجع بدون عبور هیچ گونه جریان قابل ملاحظه ای در الکترود مرجع کنترل شود و جریان مجبور می شود بین الکترود کار و الکترود کمکی جریان یابد.
این کار دو مزیت اصلی دارد:
-
ابتدا الکترود مرجع از تغییرات الکتروشیمیایی داخلی ناشی از جریان محافظت می شود.
-
دوم، خطاهای اندازه گیری مربوط به مقاومت محلول آزمایشی به حداقل می رسد.
[جهت مطالعه بیشتر به مقاله ولتامتری،ولتاموگرام مراچعه کنید.]
انواع ولتامتری در شیمی تجزیه
انواع ولتامتری وجود دارد. هر کدام با توجه به روش تغییر پتانسیل الکترود کار در طول آزمایش متفاوت هستند.
-
در برخی ازتکنیک ها، یک روبش پتانسیل روی الکترود کار اعمال می شود،
-
در برخی دیگر، از یک پله پتانسیل ناگهانی یا دنباله پالس پیچیده استفاده می شود.
یکی دیگر از تفاوت های انواع ولتامتری این است که آیا محلول نسبت به سطح الکترود کار در حال حرکت است یا خیر.
در بیشتر موارد، محلول بدون حرکت است، اما روشهای هیدرودینامیکی زیادی وجود دارد که در آنها محلول در طول یک الگوی جریان کاملاً مشخص به سمت الکترود حرکت میکند.
[جهت مطالعه بیشتر به مقاله انواع ولتامتری مراچعه کنید.]
نمونه گزارشکار آزمایشگاه شیمی تجزیه 2
این آزمایش دو تکنیک بسیار رایج ولتامتری، ولتامتری چرخه ای و کرونوآمپرومتری را با یک تکنیک هیدرودینامیکی به نام ولتامتری دیسک چرخان مقایسه می کند.
این سه تکنیک اشتراکات زیادی دارند، اما هر کدام پاسخ آزمایش منحصر به فرد خود را می دهند. به منظور ارائه یک مقایسه بسیار مستقیم، محلول آنالیت یکسان، با استفاده از هر سه تکنیک مورد تجزیه و تحلیل قرار می گیرد.
آنالیت مورد استفاده در این آزمایش آنیون فری سیانید Fe(CN)6-3، است که حاوی یک اتم آهن در حالت اکسیداسیون +3 است.
در سطح یک الکترود کار، یک الکترون منفرد را می توان به آنیون فری سیانید اضافه کرد. این باعث می شود که آنالیت به آنیون فروسیانید،Fe(CN)6 -4،که حاوی یک اتم آهن در حالت اکسیداسیون +2 است، کاهش یابد.
این تبادل الکترون ساده بین آنالیت و الکترود رفتار بسیار خوبی دارد و برگشت پذیر است. این بدان معنی است که آنالیت را می توان به راحتی به Fe(CN)6 -4 کاهش داد و سپس به راحتی دوباره به Fe(CN)6-3 اکسید کرد.
یک جفت آنالیت که فقط در حالت اکسیداسیون متفاوت است به عنوان زوج ردوکس شناخته می شود. نیمه واکنش الکتروشیمیایی برای زوج ردوکس Fe(CN)6-3/ Fe(CN)6 -4 را می توان به صورت زیر نوشت:
پتانسیل فرمال مرتبط با این نیمه واکنش نزدیک به +400 میلی ولت در مقابل الکترود هیدروژن معمولی (NHE) است.
- اگر الکترود کار در پتانسیل مثبت تر از +400 میلی ولت نگه داشته شود، آنالیت تمایل دارد تا به شکل Fe(CN)6-3 اکسید شود. این اکسیداسیون در الکترود کار باعث می شود یک جریان آندی جریان یابد (یعنی الکترون ها از محلول به الکترود می روند).
- در پتانسیل های منفی تر از +400 میلی ولت، آنالیت تمایل دارد تا به Fe(CN)6 -4 کاهش یابد. این کاهش در الکترود کار باعث جریان کاتدی می شود (یعنی الکترون ها از الکترود به سمت محلول خارج می شوند).
ولتامتری چرخه ای در تجزیه 2
در ولتامتری چرخه ای، پتانسیل الکترود کار در پتانسیل فرمال آنالیت به جلو و عقب روبش شده و کاهش و اکسیداسیون مکرر آنالیت باعث جریان متناوب کاتدی و آندی در الکترود می شود.
در این روش محلول هم زده نمی شود و نتایج تجربی معمولاً به صورت نمودار جریان در مقابل پتانسیل رسم میشوند و ولتاموگرافی مانند آنچه در شکل 3.3 نشان داده شده است، ثبت میگردد.
ولتاموگرام دو پیک نامتقارن را نشان می دهد، یکی کاتدی و دیگری آندی. سیگنال مورد علاقه شیمیدانان ارتفاع پیک است. ارتفاع پیک،iP،به طور مستقیم با غلظت آنالیت، C، متناسب است و توسط معادله Randles-Sevcik توضیح داده شده است:
[جهت مطالعه بیشتر به مقاله ولتامتری چرخه ای مراچعه کنید.]
کرونوآمپرومتری در تجزیه 2
در کرونوآمپرومتری، پتانسیل الکترود کار به طور ناگهانی از یک پتانسیل اولیه به یک پتانسیل نهایی گام برداشته می شود و این پله معمولاً از پتانسیل فرمال آنالیت عبور می کند.
محلول هم زده نمی شود. پتانسیل اولیه به گونه ای انتخاب می شود که هیچ جریانی از آنالیت وجود نداشته باشد (به عنوان مثال، الکترود در پتانسیلی قرار می گیرد که آنالیت را اکسید یا کاهش نمی دهد).
سپس، پتانسیل به پتانسیلی می رسد که آنالیت را اکسید یا کاهش میدهد و جریان آنالیت در الکترود برقرار می شود. این جریان در ابتدا بسیار زیاد است، اما با مصرف آنالیت در نزدیکی الکترود، به سرعت از بین می رود (شکل 3.9 را ببینید).
سیگنال در کرونوآمپرومتری گذرا است. اگر نقطه زمانی که پتانسیل روبش میکند به عنوان زمان صفر در نظر گرفته شود، آنگاه معادله کاترل چگونگی کاهش جریان، i(t)، را به عنوان تابعی از زمان، t توصیف می کند.
اگرچه نحوه فروپاشی ممکن است نمایی به نظر برسد، اما در واقع به صورت متقابل جذر زمان تحلیل میرود. این وابستگی به جذر زمان نشان دهنده این واقعیت است که انتشار فیزیکی مسئول انتقال آنالیت به سطح الکترود است.
ولتامتری دیسک چرخان در تجزیه 2
ولتامتری دیسک چرخان شبیه ولتامتری چرخه ای است که پتانسیل الکترود کار (به آرامی) در پتانسیل فرمال آنالیت به جلو و عقب روبش می شود.
تفاوت قابل توجه دو تکنیک در این است که در اینجا خود الکترود کار با سرعت بسیار بالایی می چرخد. این حرکت چرخشی یک جریان خوب مشخص از محلول را به سمت سطح الکترود دیسک دوار ایجاد می کند.
الگوی جریان شبیه گردابی است که به معنای واقعی کلمه محلول (و آنالیت) را به سمت الکترود می مکد. نتایج تجربی عموماً به صورت نمودار جریان در مقابل پتانسیل رسم می شوند و یک ولتاموگرام دیسک چرخان معمولی در شکل 3.6 نشان داده شده است.
ولتاموگرام یک موج سیگموئیدی را نشان می دهد و ارتفاع این موج سیگنال تحلیلی را ارائه می دهد.
توجه به این نکته ضروری است که لایه محلول در مجاورت سطح الکترود طوری رفتار می کند که گویی به الکترود چسبیده است و در حالی که قسمت اعظم محلول به شدت توسط الکترود دوار هم زده می شود، این لایه نازک از محلول موفق می شود به سطح الکترود بچسبد و (از دیدگاه الکترود دوار) بی حرکت به نظر می رسد. این لایه را لایه راکد می نامند تا آن را از قسمت عمده محلول متمایز کند.
آنالیت با ترکیبی از دو نوع انتقال به سطح الکترود منتقل می شود.
-
ابتدا، جریان گردابی در محلول حجیم به طور مداوم آنالیت تازه را به لبه بیرونی لایه راکد می آورد.
-
سپس، آنالیت از طریق انتشار مولکولی ساده در سراسر لایه راکد حرکت می کند.
هر چه لایه راکد نازکتر باشد، آنالیت سریعتر میتواند در سراسر آن پخش شود و به سطح الکترود برسد. چرخش سریعتر الکترود باعث نازکتر شدن لایه راکد میشود. بنابراین، سرعت چرخش سریعتر به آنالیت اجازه می دهد تا سریعتر به الکترود برسد و در نتیجه جریان بالاتری در الکترود اندازه گیری می شود.
معادله لویچ جریان مشاهده شده در الکترود دیسک دوار را پیش بینی می کند. این معادله هم سرعت انتشار در لایه راکد و هم الگوی جریان حل پیچیده را در نظر می گیرد. به طور خاص، معادله لویچ ارتفاع موج سیگموئیدی مشاهده شده در ولتامتری دیسک چرخان را نشان می دهد.
ارتفاع موج سیگموئیدی، اغلب جریان لویچ،iL ، نامیده می شود و با غلظت آنالیت، C نسبت مستقیم دارد. معادله لویچ به صورت زیر نوشته می شود.
که در آن
-
w نرخ چرخش زاویه ای الکترود (رادیان/ثانیه)
-
V ویسکوزیته سینماتیکی محلول (cm2/sec) است.
ویسکوزیته سینماتیکی نسبت ویسکوزیته محلول به چگالی آن است.
-
برای آب خالص، v = 0.0100 cm2 /sec،
- و برای حلال مورد استفاده در این آزمایش (1.0M KNO3)، v = 0.00916 cm2 /sec.
[جهت مطالعه بیشتر به مقاله بررسی انواع الکترود دوار مراچعه کنید.]
گزارش کار آزمایشگاه تجزیه 2
دستگاه های تجزیه ای مورد نیاز آزمایشگاه
- آنالایزر الکتروشیمیایی BHP 2066
- بسته نرم افزاری BHP 2066
- RDE شرکت بهپژوه
- الکترود دیسک چرخانده پلاتین
- سلول سه الکترود (با دهانه بزرگ برای الکترود دیسک چرخان)
- الکترود کمکی پلاتین
- الکترود مرجع SCE
- محلول پولیش آلومینا
(جهت مطالعه تجهیزات لازم برای آزمایشگاه الکتروشیمی کلیک کنید.)
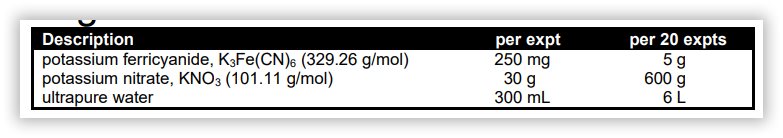
معرف ها و مواد شیمیایی آزمایشگاه تجزیه 2
روش کار در آزمایشگاه شیمی تجزیه 2
تمام ظروف شیشه ای مورد استفاده برای الکتروشیمی باید تا حد امکان تمیز باشند. حلال ها و معرف های مورد استفاده برای ساخت محلول ها باید تا حد امکان خالص باشند. یک منبع آب فوق خالص برای تهیه محلول مناسب مورد نیاز است. آب فوق خالص می تواند آب دییونیزه، اولترافیلتر شده (DIUF) یا آب رسانایی یا آب درجه HPLC باشد.
الف- گزارشکار آماده سازی محلول جهت آزمایش
دو محلول مورد نیاز برای این آزمایش باید توسط دانش آموز تهیه شود.
- محلول الکترولیت: 1.0 مولار نیترات پتاسیم (KNO3) در آب .این محلول یک حلال رسانای الکتریکی مناسب جهت استفاده در ولتامتری است.
- محلول آنالیت: یک محلول 6.4 میلی مولار از فری سیانید پتاسیم است که با استفاده از محلول الکترولیت به عنوان حلال، ساخته شده است.
1) گزارشکار تهیه محلول الکترولیت (250 میلی لیتر):
یک بالن حجمی 250 میلی لیتری بسیار تمیز تهیه کنید و مطمئن شوید که آخرین شستشوی این بالن با آب فوق خالص انجام شود. حدود 25.30 گرم نیترات پتاسیم (KNO3) را به بالن منتقل کنید. بالن را با حدود 200 میلی لیتر آب فوق خالص پر کنید و اجازه دهید نیترات پتاسیم حل شود. پس از انحلال کامل، بالن را با آب فوق خالص «تا خط» پر کنید و خوب مخلوط کنید. محلول حاصل حدود KNO3 1.0M است.
2) گزارشکار تهیه محلول آنالیت (100 میلی لیتر):
یک بالن حجمی 100 میلی لیتری بسیار تمیز تهیه کنید و مطمئن شوید که آخرین شستشوی این بالن با آب فوق خالص انجام شده است. با استفاده از یک میکروبالانس حساس، دقیقاً 210.7 میلی گرم فری سیانید پتاسیم K3Fe(CN)6 را به داخل بالن منتقل کنید. بالن را با حدود 75 میلی لیتر محلول الکترولیت پر کنید و اجازه دهید K3Fe(CN)6 حل شود. پس از انحلال کامل، بالن را با استفاده از محلول الکترولیت “تا خط” پر کنید و خوب مخلوط کنید. محلول حاصل باید غلظت آنالیت 6.4 میلی مولار داشته باشد، اما دانشجو باید غلظت دقیق تری را بر اساس جرم واقعی K3Fe(CN)6 که برای تهیه محلول استفاده شده است محاسبه کند.
ب.گزارشکار آزمایش اسکن بک گراند
یک ولتاموگرام پس زمینه ساده از محلول الکترولیت خالص، راه خوبی برای تایید خلوص محلول، تمیزی ظروف شیشه ای و آماده سازی الکترود کاری صیقلی در یک مرحله است.
جهت مطالعه بیشتر کلیک کنید.
ج. دستورکار آزمایش ولتامتری چرخه ای
در این بخش از آزمایش، چندین ولتاموگرام چرخهای با استفاده از نرخهای جابجایی مختلف بهدست میآیند. محلول آنالیت یکسانی باید برای همه ولتاموگرام ها استفاده شود و الکترود نباید در حال چرخش باشد.
1) یک سلول الکتروشیمیایی تمیز را به یک الکترود مرجع SCE و یک الکترود کمکی پلاتین مجهز کنید. الکترود کار دیسک پلاتین را با دقت در چرخاننده نصب کنید و سپس آن را در سلول پایین بیاورید. (توجه داشته باشید که الکترود در طول این بخش از آزمایش نباید چرخانده شود، چرخاننده به سادگی به عنوان یک روش مناسب برای نصب الکترود عمل می کند.)
2) سلول الکتروشیمیایی را با محلول آنالیت پر کنید. در صورت تمایل، ممکن است اکسیژن در سلول ابتدا با حباب زدن نیتروژن در محلول و سپس پوشاندن مداوم محلول با جریان ثابت نیتروژن در طول مدت آزمایش، پاکسازی شود. با این حال، بعید است که اکسیژن در این آزمایش تداخل داشته باشد.
3) پتانسیواستات شرکت بهپژوه را روشن کنید و تمام اتصالات الکتریکی لازم بین الکترودها و پتانسیواستات را برقرار کنید.
4) نرم افزار Behpajooh Software را اجرا کنید.
از قسمت:
port setting-->load--->port name
اتصال را انتخاب کرده سپس setرا زده و وارد پنل نرم افزار شوید.
5) از پانل techniques، تکنیک Cyclic voltammetry (ولتامتری چرخه ای) را انتخاب کنید. و تنظیمات را مطابق شکل وارد کنید.توجه داشته باشید که این تنظیمات برای یک آزمایش ولتامتری چرخهای است که در آن پتانسیل از +800 میلیولت به 100- میلیولت کاهش مییابد و با نرخ روبش 200 میلیولت بر ثانیه باز میگردد.
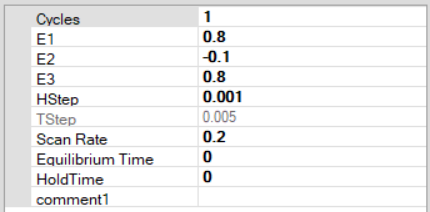
6) هنگامی که تنظیمات آزمایش مطابق با شکل بالا تنظیم شد، روی دکمه Run کلیک کنید تا آزمایش شروع شود. یک موج کاتدی نسبتاً برجسته باید در حین حرکت از 800+ میلی ولت تا 100- میلی ولت ظاهر شود. در حرکت برگشت، یک موج آندی با اندازه مساوی باید ظاهر شود.
شکل زیر یک ولتاموگرام معمولی از فری سیانید پتاسیم را نشان می دهد. توجه داشته باشید که همانطور که توسط نرم افزار نشان داده شده است، پتانسیل های مثبت در سمت راست و جریان های آندی به سمت بالای نمودار رسم می شوند.
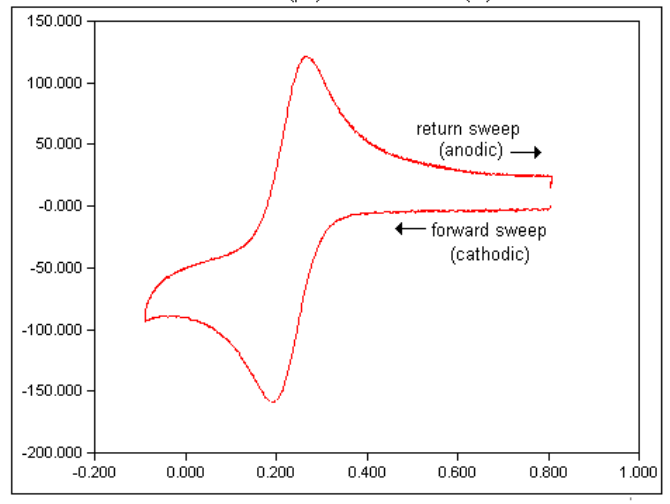
7) پس از به دست آوردن یک ولتاموگرام رضایت بخش، آن را روی دیسک ذخیره کنید.
8) از ابزار Peak Search موجود در منوی جعبه ابزار قسمت Show Results and Analyse ،برای اندازه گیری ارتفاع پیک آندی استفاده کنید. هم ارتفاع پیک و هم سرعت رفت و برگشت را در دفترچه یادداشت آزمایشگاهی خود یادداشت کنید.
9) علاوه بر ولتاموگرامی که در 200 میلی ولت بر ثانیه به دست آمده است، مراحل 5 تا 8 را در صورت نیاز تکرار کنید تا ولتاموگرام را با این چهار سرعت روبش : 150، 100، 75 و 50 میلی ولت در ثانیه دریافت کنید. در هر مورد، حتماً سرعت رفت و برگشت و ارتفاع پیک را در دفترچه یادداشت آزمایشگاهی خود یادداشت کنید.
10) محلول آنالیت را برای استفاده در قسمت بعدی آزمایش در سلول الکتروشیمیایی بگذارید.
د. گزارشکار ولتامتری دیسک چرخان
در این قسمت از آزمایش، چندین ولتاموگرام دیسک چرخانده با استفاده از نرخ های چرخش مختلف به دست می آید. همان محلول آنالیت برای همه ولتاموگرافی ها استفاده می شود.
11) الکترود چرخان را روشن کرده و سرعت چرخش الکترود را روی 4000 RPM تنظیم کنید. مطمئن شوید که جریان محلول در سلول غیر آشفته است و سطح الکترود دوار در محلول غوطه ور می ماند.
12) از پانل techniques، تکنیک Cyclic voltammetry (ولتامتری چرخه ای) را انتخاب کنید. و تنظیمات را مطابق شکل وارد کنید.توجه داشته باشید که این تنظیمات برای یک آزمایش ولتامتری چرخهای است که در آن پتانسیل با نرخ روبش 10 میلیولت بر ثانیه، از +500 میلیولت به 100- میلیولت کاهش مییابد و سپس باز میگردد.
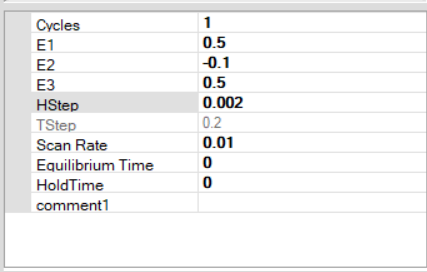
13) هنگامی که تنظیمات آزمایش مطابق با شکل بالا تنظیم شد، روی دکمه Run کلیک کنید تا آزمایش شروع شود. یک موج کاتدی نسبتاً برجسته باید در حین حرکت از 500+ میلی ولت تا 100- میلی ولت ظاهر شود.موج باید ظاهری سیگموئیدی داشته باشد (به جای شکل پیک نامتقارن مشاهده شده در طول ولتامتری چرخه ای). در رفت و برگشت برگشت، سیگنال فعلی باید مسیری را که در حین حرکت رو به جلو دنبال میشود، طی کند.
شکل زیر یک ولتاموگرام دیسک چرخان معمولی برای فری سیانید پتاسیم را نشان می دهد. توجه داشته باشید که همانطور که توسط نرم افزار نمایش داده می شود، پتانسیل های مثبت در سمت راست و جریان های کاتدی به سمت پایین نمودار رسم می شوند.
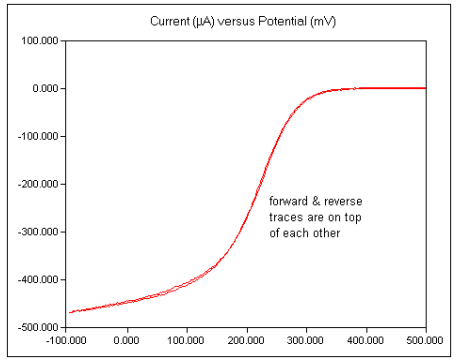
14) پس از به دست آوردن یک ولتاموگرام رضایت بخش، آن را روی دیسک ذخیره کنید.
15) از ابزار Peak Search موجود در منوی جعبه ابزار قسمت Show Results and Analyse ،برای اندازه گیری ارتفاع پیک آندی استفاده کنید. ارتفاع پیک و میزان چرخش را در دفترچه یادداشت آزمایشگاهی خود یادداشت کنید. توجه داشته باشید که ارتفاع سیگموئید جریان لویچ است.
16) علاوه بر ولتاموگرامی که در 4000 RPM بدست آمده است، مراحل 13 تا 15 را تکرار کنید و ولتاموگرام دیگری را با چهار سرعت چرخش ثبت کنید: 3200، 2500، 1600 و 900 RPM. در هر مورد، حتماً نرخ چرخش و جریان لویچ را در نوت بوک آزمایشگاهی خود یادداشت کنید.
17) محلول آنالیت را برای استفاده در قسمت بعدی آزمایش در سلول الکتروشیمیایی بگذارید.
ه. گزارشکار کرونوآمپرومتری در آزمایشگاه تجزیه 2
در این قسمت از آزمایش، یک مرحله پتانسیل ساده روی الکترود کار اعمال می شود و یک نتیجه کرونوآمپرومتری ثبت می شود.
18) روتیتور الکترود را خاموش کنید و منتظر بمانید تا محلول از حرکت باز بماند.
19) از پانل techniques، تکنیک Chrono Amperometry (کرونوآمپرومتری) را انتخاب کنید. و تنظیمات را وارد کنید. این تنظیمات برای آزمایش کرونوآمپرومتری است که در آن پتانسیل الکترود کار از -500 میلی ولت به صفر میلی ولت حرکت میکند.
20) هنگامی که تنظیمات آزمایش تنظیم شد، روی دکمه Run کلیک کنید تا آزمایش شروع شود.یک جریان گذرا که به سرعت از بین می رود باید مشاهده می شود. شکل زیر یک نتیجه کرونوآمپرومتری برای محلول فری سیانید پتاسیم را نشان می دهد. توجه داشته باشید که جریان های کاتدی در جهت پایین رسم می شوند.
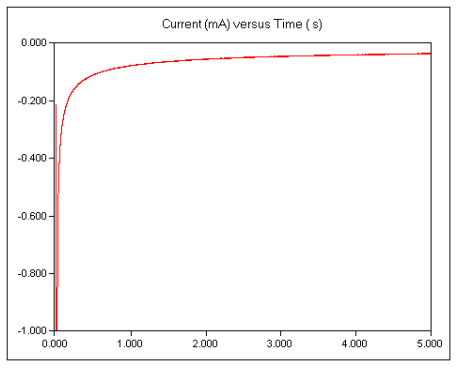
21) پس از به دست آوردن یک نتیجه کرونوآمپرومتری رضایت بخش، آن را روی دیسک ذخیره کنید .
22) با کلیک راست بر روی دیتا و انتخاب گزینه Show Data Points ،ده نقطه داده را از نتایج خود انتخاب کنید و زمان و جریان را برای هر یک از ده نقطه یادداشت کنید. مطمئن شوید که ده نقطه داده ای که انتخاب می کنید کل محدوده داده های مفید از 100 میلی ثانیه تا 5 ثانیه را در بر می گیرند. این داده ها بعداً برای تولید نمودار کاترل استفاده می شود.
تجزیه و تحلیل دادهها در آزمایشگاه تجزیه 2
ولتامتری چرخهای در شیمی تجزیه 2
a) با استفاده از جریانهای پیک کاتدی از سری ولتاموگرام های چرخهای که با نرخهای روبش مختلف به دست میآیند، نموداری از جریان پیک در مقابل جذر سرعت جابجایی، تهیه کنید.
b) تجزیه و تحلیل حداقل مربعات خطی را روی داده ها انجام دهید تا معادله بهترین خط مستقیم را که با داده ها مطابقت دارد پیدا کنید.
c) از شیب خط همراه با معادله Randles-Sevcik برای تخمین ضریب انتشار برای آنیون فری سیانید استفاده کنید. به واحدهای مناسب دقت کنید و پاسخ خود را در cm2/sec گزارش دهید.
ولتامتری دیسک چرخان در شیمی تجزیه 2
d) با استفاده از جریانهای لویچ (ارتفاع سیگموئید) از سری ولتاموگرافیهای دیسک چرخشی که با نرخهای چرخش مختلف به دست آمدهاند، نموداری از جریان لویچ در مقابل جذر سرعت چرخش زاویهای تهیه کنید. توجه داشته باشید که نرخ چرخش ممکن است با استفاده از رابطه w = 2 p f / 60 باید از واحدهای RPM به رادیان در ثانیه تبدیل شود.
e) تجزیه و تحلیل حداقل مربعات خطی را روی داده ها انجام دهید تا معادله بهترین خط مستقیم را که با داده ها مطابقت دارد پیدا کنید.
f) از شیب خط، همراه با معادله لویچ برای تخمین ضریب انتشار برای آنیون فریسیانید استفاده کنید. به واحدهای مناسب دقت کنید و پاسخ خود را در cm2/sec گزارش دهید. توجه داشته باشید که ویسکوزیته سینماتیک برای 1.0M KNO3 حدودا 0.00916 سانتی متر مربع در ثانیه است.
کرونوآمپرومتری در شیمی تجزیه 2
g) با استفاده از ده نقطه داده استخراج شده از نتیجه کرونوآمپرومتری، نموداری از جریان در مقابل متقابل جذر زمان (جریان در مقابل 1/زمان) تهیه کنید. به چنین طرحی، طرح کاترل می گویند.
h) تجزیه و تحلیل حداقل مربعات خطی را روی داده ها انجام دهید تا معادله بهترین خط مستقیم را که با داده ها مطابقت دارد، پیدا کنید.
i) از شیب خط همراه با معادله کترل برای تخمین ضریب انتشار برای آنیون فریسیانید استفاده کنید. به واحدهای مناسب دقت کنید و پاسخ خود را در cm2/sec گزارش دهید.
سوالات گزارش کار آزمایشگاه تجزیه 2
1) نتایج سه ضریب انتشار را که به دست آورده اید فهرست کنید و میانگین نتیجه را محاسبه کنید. به نظر شما کدام یک از این سه تکنیک مطمئن ترین نتیجه را به همراه داشت؟
2) برای هر سه تکنیک، روشی که توسط آن آنالیت به سطح الکترود می رسد، انتشار است. فاصله ای که یک مولکول در یک زمان معین منتشر می شود همیشه به جذر زمان مربوط می شود. نشان دهید که چگونه این وابستگی به جذر زمان در هر یک از سه تکنیک ولتامتری مورد مطالعه ظاهر می شود. (نکته: واحدهای هر یک از متغیرهای موجود در معادلات رندلز-سوجیک، لویچ و کاترل را بررسی کنید.)
نکات آزمایشگاه تجزیه 2
این آزمایش یک روش مقدماتی خوب برای آشنایی دانش آموزان با ولتامتری مدرن است. اگر در برنامه آزمایشگاهی خود فقط برای یک آزمایش ولتامتری وقت کافی دارید، این آزمایش برای آشنایی گسترده دانش آموزان با موضوع خوب است.
مزیت اصلی این آزمایش این است که وقتی دانش آموزان سلول را با محلول آنالیت پر کردند، محلول تا پایان آزمایش در سلول باقی می ماند. این آزمایش در مقایسه با روش های دیگر که شامل انتقال گسترده محلول است، بسیار سریعتر انجام می شود.
اگر دانشآموزان شما به میکروبالانس دسترسی ندارند یا اگر میخواهید مرحله آمادهسازی محلول را سادهتر کنید، یک محلول موجود تجاری از فریسیانید پتاسیم خریداری کنید. به عنوان مثال، Fisher Scientific محلول فریسیانید پتاسیم 10% (w/v) (w/v) را می فروشد. هرچند که این یک محلول استاندارد نیست، اما هنوز هم منطقی است که فرض کنیم غلظت فریسیانید پتاسیم 105.3 گرم در لیتر یا 320 میلی مولار است. با استفاده از این راه حل، دستورالعمل های مرحله (2) در روش را می توان به صورت زیر جایگزین کرد:
2) محلول آنالیت (100 میلی لیتر)
یک بالن حجمی 100 میلی لیتری بسیار تمیز تهیه کنید و مطمئن شوید که آخرین شستشوی این بالن با آب فوق خالص انجام شده است. با استفاده از یک پیپت، دقیقا 2000 میلی لیتر از محلول استوک K3Fe(CN)6 را به داخل فلاسک منتقل کنید. فلاسک را با استفاده از محلول الکترولیت “تا خط” پر کنید و خوب مخلوط کنید. با توجه به اینکه محلول استوک 320 میلی مولار K3Fe(CN)6 است، محلول آنالیت حاصل باید 6.4 میلی مولار K3Fe(CN)6 باشد. دانش آموز باید این غلظت ها را در صورت نیاز تایید کند.
هنگامی که به دست آوردن همه داده ها به پایان رسید، دانشجویان باید آنالیز داده ها را برای استخراج ضرایب انتشار انجام دهند. ایده خوبی است که به دانشجویان یک بسته نرمافزاری علمی ارائه دهیم که بتواند تحلیل حداقل مربعات خطی را انجام دهد، نه اینکه آنها را ملزم به انجام تحلیل به صورت دستی کنیم. داده های تجربی مورد استفاده برای تهیه ارقام این سند برای مرجع شما تجزیه و تحلیل شده است. همه این داده ها با استفاده از یک الکترود دیسک دوار پلاتین (قطر 5.0 میلی متر، مساحت 0.1963 سانتی متر مربع) برای مطالعه محلول 2.55 میلی مولار فریسیانید پتاسیم به دست آمد. توجه داشته باشید که این غلظت آنالیت کمتر از غلظت مورد نیاز در این روش است.
نمونه نتایج ولتامتری چرخه ای در تجزیه 2
شکل زیر موج کاتدی هر یک از پنج ولتاموگرام گرفته شده در 200، 150، 100، 75 و 50 میلی ولت بر ثانیه را نشان می دهد. همانطور که انتظار می رود، جریان پیک با نرخ روبش بزرگتر، افزایش می یابد. معادله Randles-Sevcik پیشبینی میکند که جریان پیک باید متناسب با جذر نرخ جابجایی باشد. برای آزمایش خاص نشان داده شده در شکل 3.10، مساحت الکترود، A، 0.1963 سانتی متر مربع و غلظت، C، 2.55 میلی مولار بود.
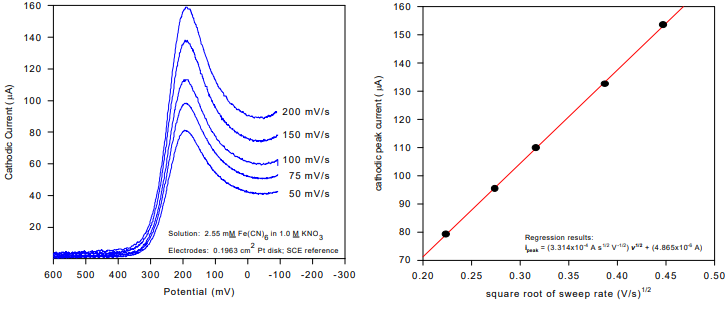
همانطور که انتظار می رود، نمودار پیک جریان در مقابل جذر سرعت جابجایی یک خط مستقیم به دست می دهد. معادله Randles-Sevcik را می توان برای بیان شیب این خط مستقیم به صورت زیر تغییر داد:
ثابت واحد دارد (یعنی 2.687×105 C mol–1 V –1/2). برای نتایج در شکل ،شیب: 3.314×10-4 A s1/2 V -1/2 است. پس از تعویض دقیق و تجزیه و تحلیل واحد، می توانید ضریب انتشار، D را حل کنید و مقداری برابر با 6.057×10-6 cm2 /s بدست آورید.
نمونه نتایج ولتامتری دیسک چرخان در الکتروشیمی پیشرفته
در اینجا نتایج مربوط به یک سری ولتاموگرام دیسک چرخان با سرعت های مختلف اسکن، گرفته شده است. از چنین مطالعه ای به عنوان مطالعه لویچ یاد می شود. جریان محدود کننده (یا جریان لویچ) اندازه گیری شده و در برابر جذر سرعت چرخش رسم می شود و نمودار لویچ تولید می شود. توجه داشته باشید که نرخ چرخش تجربی، f، بر حسب RPM اندازه گیری می شود و باید با استفاده از معادله f = 2 p w / 60 به سرعت چرخش زاویه ای w تبدیل شود، به طوری که دارای واحد رادیان در ثانیه باشد.
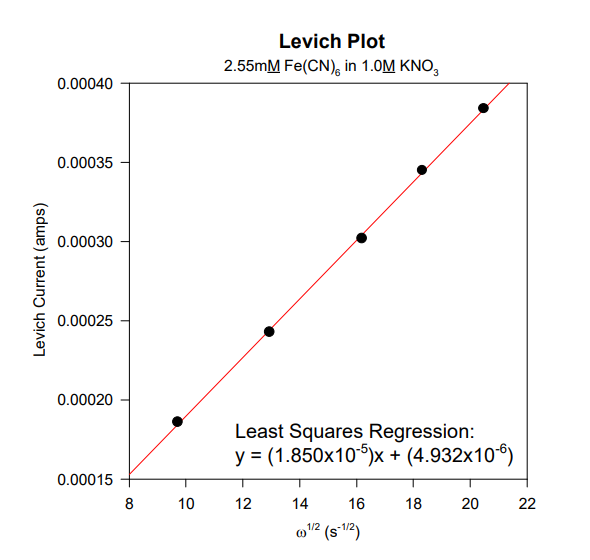
رابطه خطی بین جریان لویچ و جذر سرعت چرخش از نمودار لویچ آشکار است. برازش حداقل مربعات خطی داده ها معادله ای را برای بهترین خط مستقیمی که از داده ها عبور می کند ایجاد می کند. از معادله لویچ، معادله ای برای شیب می توان نوشت:
سطح الکترود، A، 0.1963 سانتی متر مربع، غلظت آنالیت، C، 2.55×10-6 mol/cm3 بود، و محلول دارای ویسکوزیته سینماتیک، n، برابر با 0.00916 سانتی متر مربع بر ثانیه بود. پس از تجزیه و تحلیل ، می توانید ضریب انتشار، D را محاسبه کنید و مقداری برابر با 4.75×10-6 cm2 /s بدست آورید. این نتیجه کمی پایین است که احتمالاً به دلیل شکل ضعیف سیگنال سیگموئیدی مشاهده شده در این آزمایش خاص است.
ویسکوزیته سینماتیکی نسبت ویسکوزیته مطلق یک محلول به چگالی آن است. ویسکوزیته مطلق بر حسب پویز اندازه گیری می شود (1 پویز = گرم بر سانتی متر ثانیه). ویسکوزیته سینماتیکی بر حسب استوک اندازه گیری می شود (1 استوک = cm2 sec-1). جداول گسترده ویسکوزیته محلول و اطلاعات بیشتر در مورد واحدهای ویسکوزیته را می توان در کتابچه راهنمای شیمی و فیزیک CRC یافت.
نمونه نتایج کرونوآمپرومتری در اینجا نتایج یک آزمایش کرونوآمپرومتری معمولی است.
نه نقطه داده از داده های تجربی نشان داده شده در شکل کرونو آمپروگرام انتخاب شده است. این 9 نقطه به صورت جریان در مقابل متقابل جذر زمان رسم می شوند. در این نوع نمودار که نمودار کاترل نامیده می شود، انتظار می رود که نقاط داده در امتداد یک خط مستقیم قرار گیرند که در شکل زیر نشان داده شده است.
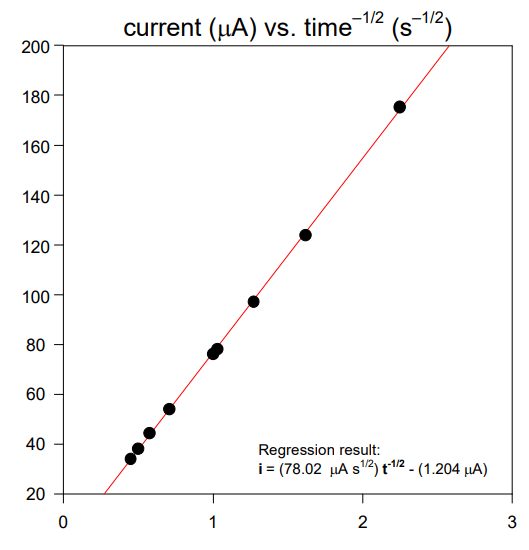
یک رگرسیون حداقل مربعات خطی بر روی داده های مورد استفاده برای ساختن نمودار کاترل به منظور استخراج مقداری برای شیب خط انجام می شود. با تنظیم مجدد معادله کاترل، عبارتی برای شیب نمودار کترل را می توان به صورت زیر نوشت:
برای آزمایش خاص نشان داده شده در شکل های بالا، مساحت الکترود، A، 0.1963 سانتی متر مربع، و غلظت آنالیت، C، 2.55 میلی مولار است. جایگزینی این اطلاعات و شیب به Eqn. 3.8 مقداری برای ضریب انتشار برابر با 8.19×10-6 cm2 /sec به دست می دهد.
جواب سوالات آزمایشگاه شیمی تجزیه 2
سوال 1
نتایج معمولی دانش جویان از 6.0×10-6 تا 8.0×10-6cm2 /sec متفاوت خواهد بود.
کرونوآمپرومتری مستقیم ترین راه اندازه گیری ضرایب انتشار با اندازه سطح الکترود را فراهم می کند،و غلظت تنها منبع عدم قطعیت است. نتایج ولتامتری چرخهای به تفریق مناسب جریان پسزمینه و دانش دقیق نرخ جابجایی متکی است. نتایج ولتامتری دیسک چرخان بر دانش دقیق نرخ چرخش و ویسکوزیته سینماتیکی متکی است، اما کمتر در معرض خطای جریانهای غیر فارادیک هستند.
سوال 2
وابستگی زمان t-1/2 برای کرونوآمپرومتری از معادله کاترل آشکار است. برای ولتامتری حلقوی، معادله Randles-Sevcik شامل جذر نرخ جابجایی است که وابستگی زمانی t-1/2 را منعکس میکند. در ولتامتری دیسک چرخان، معادله لویچ جذر سرعت چرخش را شامل می شود، که باز هم وابستگی زمانی t-1/2 را منعکس می کند.
(جهت مطالعه دستور کار آزمایشگاه الکتروشیمی (مقدمه)، کلیک کنید.)
(جهت مطالعه ولتامتری چرخه ای: تعین غلظت آهن مجهول کلیک کنید.)
References
Educator’s Reference Guide for Electrochemistry
1) R.N. Adams, Electrochemistry at Solid Electrodes (Marcel Dekker: NewYork, 1969) ch. 8.
2) A.J. Bard, L.R. Faulkner, Electrochemical Methods: Fundamentals and Applications (John Wiley & Sons: New York, 1980) ch.6.