انواع ولتامتری
انواع ولتامتری
در زیر چند مورد از انواع ولتامتری نام برده شده است و در ادامه سه دسته کلی از انواع ولتامتری را بررسی می کنیم.
-
ولتامتری روبش خطی : Linear Sweep Voltammetry
-
ولتامتری چرخه ای : Cyclic Voltammetry
-
ولتامتری پالس نرمال : Normal Pulse Voltammetry
-
ولتامتری پالس تفاضلی : Differential Pulse Voltammetry
-
ولتامتری موج مربعی : Square Wave Voltammetry
- (شما میتوانید تکنیکهای فوق را با دستگاه انالایزر الکتروشیمی BHP-2066 اجرا کنید.)
تکنیک های اصلی و لتامتری
ده ها تکنیک ولتامتری محبوب را می توان در سه دسته کلی قرار داد:
-
تکنیک های روبشی،
-
تکنیک های پالسی (یا مرحله ای)
-
تکنیک های هیدرودینامیکی.
بسیاری از تکنیکهای موجود از انواع ولتامتری،کاملاً مشابه هستند، اما الکتروشیمیدانان با توجه به تفاوتهای ظریف بین آنها، نامهای مختلفی به آنها دادهاند.
در همه موارد، پتانسیل الکترود به روشی قابل پیشبینی تغییر میکند، به طوری که آنالیت در سطح الکترود اکسید یا کاهش مییابد و یک گرادیان غلظت قابل پیشبینی ایجاد شده و یک پاسخ جریان قابل پیشبینی به وجود می آید.
تکنیکهای روبشی برای بررسی رفتار الکتروشیمیایی عمومی آنالیتها در یک محلول ترجیح داده میشوند، در حالی که تکنیکهای مرحلهای(step) عموماً اطلاعات کمی بهتری ارائه میدهند. تکنیک های هیدرودینامیکی شامل هم زدن محلول آزمایشی به دلایلی است که در زیر توضیح داده شده است.
روشهای استپ و پالس پتانسیل از انواع ولتامتری
سادهترین تکنیک الکتروآنالیز از انواع ولتامتری پالسی، کرونوآمپرومتری نامیده میشود و شامل استپ گذاری پتانسیل الکترود از پتانسیل اولیه به پتانسیل نهایی است.
پتانسیل های اولیه و نهایی طوری انتخاب می شوند که پتانسیل فرمال، Eo، آنالیت در بازه قرار گیرد.
- در پتانسیل اولیه، جریان قابل توجهی از الکترود عبور نمی کند.
- هنگامی که پتانسیل به پتانسیل نهایی رسید، آنالیت در سطح الکترود شروع به مصرف شدن می کند (از طریق اکسیداسیون یا کاهش).
- این باعث کاهش غلظت آنالیت در نزدیکی الکترود به حدی می شود که اساساً در سطح الکترود به صفر می رسد.
- تخلیه ناگهانی آنالیت در سطح الکترود یک گرادیان غلظت بسیار بزرگ ایجاد می کند،
بنابراین تعجب آور نیست که یک جریان بسیار بزرگ بلافاصله پس از استپ مشاهده شود. با گذشت زمان، لایه انتشار شروع به گسترش بیشتر به داخل محلول می کند و گرادیان غلظت به آرامی آرام میگیرد.
این بدان معنی است که موج اولیه جریان با گذشت زمان به مقادیر کوچکتر کاهش می یابد.
بزرگی جریان گذرا، i(t)، متناسب با غلظت آنالیت، C است، و فروپاشی آن با زمان توسط معادله کاترل توصیف میشود.
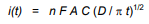
در این معادله،
-
n تعداد الکترون هایی است که در نیمه واکنش مبادله می شود،
-
F ثابت فارادی (96485 C / mol)،
-
A سطح الکترود (cm2)
-
D ضریب انتشار آنالیت (cm2 /sec) است.
دادههای تجربی معمولاً به صورت i(t) در مقابل t -1/2 رسم میشوند و یک نمودار خط مستقیم به نام نمودار کاترل به دست میآید.
شیب این نمودار به طور مستقیم با غلظت متناسب است و ممکن است به عنوان مبنایی برای تعیین تحلیلی استفاده شود.
برای محلول هایی که غلظت آنالیت از قبل مشخص است، می توان از شیب برای اندازه گیری ضریب انتشار آنالیت استفاده کرد.
یک تغییر آزمایش کرونوآمپرومتری ساده که شامل بازگشت به پتانسیل اولیه پس از مدتی است، کرونوآمپرومتری پله پتانسیل دوگانه (DPSCA) نامیده می شود.
نقطه قوت اصلی این آزمایش توانایی آن در بررسی آنالیت پس از اکسید شدن یا کاهش آن توسط الکترود است.
اشکال اکسید شده یا احیا شده آنالیت ها اغلب ناپایدار هستند و ممکن است تحت واکنش های شیمیایی مختلف از جمله تجزیه قرار گیرند. DPSCA راهی برای اندازه گیری اینکه آیا این فرآیندهای تجزیه رخ می دهند؟با چه سرعتی؟ ارائه می دهد.
توالی پالس پتانسیل پیچیده تری نیز ممکن است روی الکترود اعمال شود.
تکنیک هایی مانند پالس ولتامتری و دیفرانسیل پالس ولتامتری شامل یک سری استپ های پتانسیل برای رسیدن به پتانسیل های بزرگتر است.
این تکنیکها میتوانند بین جریانهای ناشی از فرآیندهای ردوکس آنالیت و جریانهای ناشی از فرآیندهای پسزمینه تمایز قائل شوند و هم دادههای فعلی در مقابل زمان و هم دادههای فعلی در مقابل پتانسیل را ارائه میدهند.
به جای افزایش ناگهانی پتانسیل، اغلب مطلوب است که به آرامی آن را با سرعت ثابت از یک پتانسیل به پتانسیل دیگر روبش کنید.
ساده ترین آزمایش روبشی، ولتامتری روبشی خطی نامیده می شود و شامل یک روبش از یک پتانسیل اولیه تا یک پتانسیل نهایی است.
همانند کرونوآمپرومتری، پتانسیل های اولیه و نهایی به گونه ای انتخاب می شوند که پتانسیل فرمال، Eo را برای آنالیت دربرگیرند.
در ابتدا، آنالیت تحت تأثیر الکترود قرار نمیگیرد، اما با افزایش پتانسیل تا پتانسیل فرمال، شروع به اکسید شدن (یا کاهش) توسط الکترود میکند. این یک گرادیان غلظت ایجاد می کند و یک جریان گذرا مشاهده می شود.
جریان گذرای مشاهده شده در ولتامتری روبشی به آنچه که توسط آزمایش کرونوآمپرومتری ایجاد می شود،شبیه است، اما آنقدرها “تیز” نیست زیرا پتانسیل به جای گام برداشتن ناگهانی روبش می شود.
مجدداً، جریان متناسب با غلظت است و پیک جریان گذرا، ip، توسط معادله Randles-Sevcik به دست میآید.
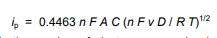
در این معادله،
-
n تعداد الکترونهایی است که در نیمه واکنش برای زوج ردوکس ظاهر میشوند،
-
v سرعت جابجایی پتانسیل است (V / ثانیه)،
-
F ثابت فارادی (96485 C / mol)،
-
A مساحت الکترود (cm2)،
-
R ثابت گاز جهانی (8.314 J/mol K)،
-
T دمای مطلق (K)
-
D ضریب انتشار آنالیت (cm2/sec) است.
توجه داشته باشید که اگر دما 25 درجه سانتیگراد (298.15K) فرض شود، Randles-Sevcik را می توان به شکل مختصرتری نوشت.
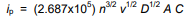
ثابت واحد دارد : (یعنی 2.687×105 C mol–1 V –1/2).
معادله Randles-Sevcik فقط زمانی اعمال میشود که سیستم اکسیداسیون و کاهش با پتانسیل روبش الکترود کار در تعادل باقی بماند.
این شرایط را می توان با مطالعه یک سیستم ردوکس با سینتیک سریع و/یا با روبش کردن پتانسیل الکترود با سرعت آهسته، مهیا کرد.
نتایج تجربی معمولاً به صورت نمودار جریان در مقابل پتانسیل به نام ولتاموگرام جابجایی خطی ارائه میشوند.
یک نوع بسیار محبوب این آزمایش، ولتامتری چرخهای، شامل روبش کردن مکرر پتانسیل به عقب و جلو بین پتانسیل اولیه و نهایی است.
این تکنیک راهی برای ارزیابی سریع رفتار یک سیستم الکتروشیمیایی فراهم می کند.
آزمایش ولتامتری چرخهای درست مانند یک آزمایش رفت و برگشت خطی آغاز میشود – آنالیت در طول روبش کردن اولیه اکسید میشود (یا کاهش مییابد) – اما در طول رفت و برگشت برگشت به شکل اولیه خود کاهش مییابد (یا اکسید میشود).
این باعث می شود که یک ولتاموگرام چرخه ای معمولی دو پیک با اندازه مساوی اما علامت مخالف را نشان دهد زیرا یک فرآیند آندی و دیگری کاتدی است.
بسیار شبیه آزمایش DPSCA که در بالا توضیح داده شد، ولتامتری حلقوی به سرنوشت آنالیت پس از اکسید شدن (یا کاهش) در الکترود حساس است.
اگر پس از اکسید شدن (یا احیا) تجزیه شود یا تحت واکنش شیمیایی دیگری قرار گیرد، در این صورت تا زمانی که روبش برگشتی شروع شود، ممکن است دیگر غلظت قابل توجهی از آنالیت در لایه انتشار وجود نداشته باشد و پیک بازگشتی از بین خواهد رفت.
گفته می شود که این نوع ولتاموگرافی برگشت ناپذیر است. ولتاموگرامهای برگشتناپذیر، اگرچه به اندازه ولتاموگرامهای برگشتپذیر جذاب نیستند، اما هنوز برای تعیینهای تحلیلی مفید هستند.
یک روبش پتانسیل نیز در ولتامتری عاری سازی آندی استفاده می شود، که نوعی تغییر ولتامتری روبشی خطی با استفاده از یک الکترود کار جیوه است.
الکترودهای جیوه توانایی منحصر به فردی برای کاهش و سپس جذب آنالیت ها (معمولا کاتیون های فلزی) از محلول آزمایشی دارند و آنها را در خود الکترود متمرکز می کنند.
هنگامی که غلظت کافی از آنالیت ها جذب شد، پتانسیل الکترود جیوه به آرامی در جهت مثبت (آندی) روبش می شود و آنالیت ها اکسید شده و از الکترود خارج می شوند.
روشهای هیدرودینامیکی از انواع ولتامتری
در تمام روشهایی که در بالا توضیح داده شد، محلول الکترود تا حد امکان ثابت نگه داشته میشود، به طوری که تنها راهی که در آن آنالیت میتواند به الکترود برسد، انتشار ساده است.
روش هایی که شامل همرفت اجباری (یعنی هم زدن) برای کمک به آنالیت برای رسیدن به الکترود است، روش های هیدرودینامیکی نامیده می شوند.
هنگامی که محلول به صورت کنترل شده هم زده می شود، یک جریان غیر متلاطم از محلول آزمایشی می تواند به سمت الکترود کار هدایت شود. محبوب ترین راه برای رسیدن به این اثر، چرخاندن خود الکترود است.
این یک جریان گردابی را در محلول آزمایش ایجاد می کند که محلول را به روشی بسیار شبیه به گردباد به سمت الکترود می مکد(منهای عوارض جانبی ناخواسته).
یک الکترود دوار معمولی یک میله استوانه ای بلند است که یک الکترود دیسکی به صورت متحدالمرکز در انتهای آن نصب شده است.

الکترود دوار محلول توده را به خوبی به هم زده و همگن نگه می دارد، اما در کمال تعجب، یک لایه نازک از محلول بلافاصله در مجاورت سطح الکترود، عملا به آن چسبیده و با آن می چرخد.
بنابراین، از دیدگاه الکترود، محلولی که در تماس مستقیم با الکترود است راکد و آرام به نظر می رسد. در حالی که عمل هم زدن الکترود، آنالیت را به سمت این لایه راکد می آورد و برای اینکه گونه واقعاً به الکترود برسد، آنالیت باید با انتشار ساده در سراسر لایه راکد حرکت کند.
بنابراین حتی اگر آنالیت با ترکیبی از همرفت و انتشار به سطح الکترود منتقل می شود، این وسیله دوم – انتشار – است که در نهایت جریان مشاهده شده در الکترود را تعیین می کند.
ویژگی منحصر به فرد جریان انتشار مشاهده شده در یک الکترود دوار این است که با زمان تغییر نمی کند.
این بدان معنی است که گرادیان غلظت در سطح الکترود نسبت به زمان ثابت می ماند.
(این مورد در ولتامتری چرخه ای یا کرونوآمپرومتری که در آن گرادیان با گذشت زمان آرام می گیرد و جریانهای مشاهدهشده با زمان تحلیل میروند، صدق نمیکند.)
زیرا ضخامت لایه انتشار در لایه راکد ثابت است و غلظت ماده آنالیت در سمت دور لایه انتشار توسط عمل همزن الکترود ثابت نگه داشته می شود، گرادیان غلظت با زمان تغییر نمی کند.
به همین دلیل، جریان هایی که با استفاده از الکترود دوار مشاهده می شوند، جریان های حالت پایدار نامیده می شوند.
معادله اساسی برای ولتامتری دیسک دوار، معادله لویچ است که در زیر آورده شده است.
این معادله فرآیند انتشار را با اثرات هیدرودینامیکی که از چرخش الکترود ایجاد میشود، جفت میکند.
هنگامی که پتانسیل الکترود از پتانسیل فرمال، Eo آنالیت عبور می کند، جریان مشاهده شده از صفر به حداکثر یا جریان محدود کننده ای می رسد که مطابق با شیب غلظتی است که می تواند در سراسر لایه انتشار با عرض ثابت حفظ شود.
ولتاموگرام حاصل (یعنی نمودار جریان در مقابل پتانسیل) دارای یک موج سیگموئیدی است که در مرکز پتانسیل فرمال قرار دارد.
جریان محدود کننده،iL اندازه گیری شده از پای موج تا فلات آن، توسط معادله لویچ به دست می آید.
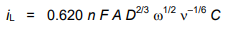
که در آن:
-
ω = 2πf، با f نرخ چرخش بر حسب دور در ثانیه،
-
n ویسکوزیته سینماتیکی محلول است
-
سایر متغیرها معانی معمول خود را دارند.
جریان محدود کننده مستقیماً با غلظت متناسب است و می تواند به عنوان مبنایی برای تعیین تحلیلی استفاده شود.
یکی از انواع الکترود دیسک چرخان، الکترود حلقه-دیسک چرخان (RRDE) است.
این الکترود ویژه دارای یک الکترود دیسکی با الکترود حلقه متمرکز با دیسک است.
هنگامی که این الکترود میچرخد، جریان گردابی که آنالیت را به سطح الکترود دیسک میآورد، پس از تماس با دیسک، آن را از کنار الکترود حلقه خارج میکند.
بنابراین آنالیت ابتدا با دیسک و سپس با حلقه روبرو می شود.
(این یکی از چندین تکنیک الکترود کار دوگانه است که همگی به استفاده از یک دو پتانسیواستات نیاز دارند.)
درست مانند آزمایشهای DPSCA و ولتامتری چرخهای که در بالا توضیح داده شد، RRDE میتواند برای تشخیص سرنوشت یک آنالیت پس از فرآیند ردوکس مورد استفاده قرار گیرد.
اگر آنالیت در طول مدت زمانی که از الکترود دیسکی به الکترود حلقه ای حرکت می کند تجزیه شود یا تحت واکنش شیمیایی دیگری قرار گیرد، زمانی که الکترود حلقه تلاش می کند آن را تشخیص دهد، به طور قابل توجهی وجود ندارد.
این آزمایش “collection” می تواند اطلاعات کمی مفیدی را در مورد سرعت واکنش های “follow-up” که پس از اکسید شدن یا کاهش آنالیت رخ می دهد، ارائه دهد.
(جهت مطالعه قسمت بعد با عنوان تجهیزات لازم برای آزمایشگاه الکتروشیمی کلیک کنید)
رفرنس:
این متن (انواع ولتامتری) ترجمه و بازنویسی مقاله ای با عنوان زیر است.
Educator’s Reference Guide for Electrochemistry

