وسایل لازم برای آزمایشگاه الکتروشیمی
مقدمه وسایل آزمایشگاه شیمی
این بخش شرح مفصلی از وسایل آزمایشگاه شیمی و راهنمایی جهت راه اندازی یک آزمایشگاه الکتروشیمیایی می باشد.همچنین شما می توانید وسایل مورد نیاز خود را از ما تهیه کنید.
تجهیزات اساسی مورد نیاز برای آزمایشگاه الکتروشیمی:
-
پتانسیواستات،
-
دستگاه ثبات
-
سلول الکتروشیمیایی
همه چیز در داخل سلول، شیمی است و هر چیزی خارج از آن الکترونیکی است.
(جهت مطالعه قسمت قبل در خصوص روشهای الکتروشیمیایی کلیک کنید)
دستگاه پتانسیواستات
عملکرد اصلی یک پتانسیواستات کنترل پتانسیل و اندازه گیری جریان است.
این دستگاه:
-
پتانسیل الکترود کار را با توجه به الکترود مرجع کنترل می کند.
-
همزمان جریان بین الکترود کار و الکترود کمکی را اندازه گیری می کند.
(جهت مطالعه در مورد پتانسیواستات کلیک کنید.)
از آنجایی که اساس ولتامتری کنترل پتانسیل الکترود است، یک ژنراتوربرای ایجاد روبش یا توالی پالس پتانسیل، برای اعمال روی الکترود کار مورد نیاز است.
بیشتر پتانسیواستاتهای مدرن شامل یک مولد روبشی و/یا پالس داخلی هستند، و آنهایی که به رایانه متصل هستند معمولاً برای تولید شکل موج مورد نظر به رایانه متکی هستند.
در پتانسیواستات هایی که فاقد مولد روبش/ پالس داخلی هستند، یا نیاز به ایجاد شکل موج بسیار تخصصی دارند ، یک ژنراتور عملکرد خارجی می تواند استفاده شود.
دستگاه خروجی
-
ورودی های پتانسیواستات، اتصالات مربوط الکترودهای موجود در سلول هستند.
-
خروجی های پتانسیواستات خطوط سیگنالی هستند که جریان و پتانسیل الکترود(های) کار را منعکس می کنند.
اگر پتانسیواستات به رایانه متصل باشد:
-
این سیگنالها مستقیماً توسط نرمافزار کنترل خوانده میشوند و دادههای آزمایشی با استفاده از رایانه دستکاری، نمایش و ذخیره میشوند.
این راحت ترین راه برای کار با پتانسیواستات است و برای محیط آموزشی توصیه می شود.
اگر از یک دستگاه خروجی مانند پلاتر X-Y یا اسیلوسکوپ دیجیتال، برای جمعآوری دادهها استفاده شود،
-
خروجیهای سیگنال در پانل جلویی پتانسیوستات در کانکتورهای نوع BNC یا موزی ارائه میشوند.
این سیگنال ها باید با استفاده از کابل های کواکسیال معمولی به پلاتر یا اسیلوسکوپ متصل شوند. چنین کابل هایی برای انتقال سیگنال های ولتاژ از یک قطعه تجهیزات آزمایشگاهی به دیگری طراحی شده اند.
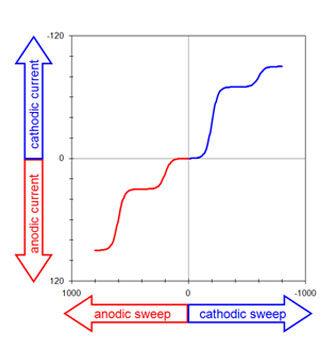
خط سیگنالی که پتانسیل الکترود کار را منعکس می کند نشان دهنده ولتاژ بین الکترودهای کار و مرجع است.
این سیگنال برای هدایت “محور X” در پلاتر استفاده می شود و حساسیت محور معمولاً بین 0.05 تا 0.20 ولت بر سانتی متر تنظیم می شود.از آنجایی که پتانسیل الکترود به ندرت از دو ولت تجاوز می کند، این محدوده حساسیت به کل ولتاموگرام ها اجازه می دهد تا روی یک تکه کاغذ قرار بگیرند.مهم است که حساسیت محور را مستقیماً روی کاغذ پلاتر یادداشت کنید تا این اطلاعات از بین نرود.
-
اگر از قرارداد ولتاموگرام آمریکای شمالی استفاده شود، قطبیت سیگنال پتانسیل معکوس می شود به طوری که پتانسیل های مثبت به سمت چپ و پتانسیل های منفی در سمت راست ترسیم می شوند.
منطق قرارداد این است که پتانسیل های منفی با انرژی های الکترون بالاتر مطابقت دارد، از این رو ولتاموگرام های آمریکای شمالی طیف های انرژی با انرژی های بالاتر به سمت راست ترسیم شده اند.
سیگنال جریان الکترود کار کمی متفاوت است. این خط سیگنال نیز به عنوان یک سیگنال ولتاژ ارائه می شود، اما سطح ولتاژ در واقع متناسب با جریانی است که از الکترود کار میگذرد.
پتانسیواستات دارای یک مدار داخلی “مبدل جریان” است که تبدیل جریان به ولتاژ لازم را به صورت خودکار انجام می دهد.
مبدل جریان دارای تعدادی محدوده است و از اپراتور انتظار می رود که مناسب ترین محدوده را برای آزمایش در حال انجام انتخاب کند.هر محدوده با یک ثابت تناسب خاص، مانند “100mA/V ” یا “1mA/V” مرتبط است.
توجه به تنظیم مبدل فعلی مستقیماً روی کاغذ در پلاتر درست پس از ثبت داده های آزمایشی مهم است. سیگنال جریان معمولاً به ورودی “محور Y” در پلاتر متصل می شود.
-
اگراز قرارداد ولتاموگرافی آمریکای شمالی استفاده شود،جریان کاتدی "بالا" در جهت مثبت و جریان آندی "پایین" در جهت منفی رسم می شود.
حساسیت “محور Y” با استفاده از یک کنترل بر روی پلاتر تنظیم می شود و معمولا دارای واحدهایی مانند “1V/cm” یا “0.1V/cm” است. توجه به حساسیت “محور Y” مستقیماً روی کاغذ در پلاتر درست پس از ثبت داده های تجربی مهم است. با ضرب حساسیت “محور Y” در تنظیم مبدل جریان، مقیاس فیزیکی مورد استفاده برای رسم جریان در واحدهایی مانند “5 mA/cm” یا “10 mA/cm” به دست می آید.
اتصالات شرح داده شده در بالا برای ثبت تقریباً هر ولتاموگرام (یعنی نمودار جریان در برابر پتانسیل) که توسط یک آزمایش الکتروشیمیایی ایجاد می شود، کافی هستند.
در آزمایشهایی مانند کرونوآمپرومتری، دادههای تجربی اغلب به صورت نمودار جریان در مقابل زمان ثبت میشوند.
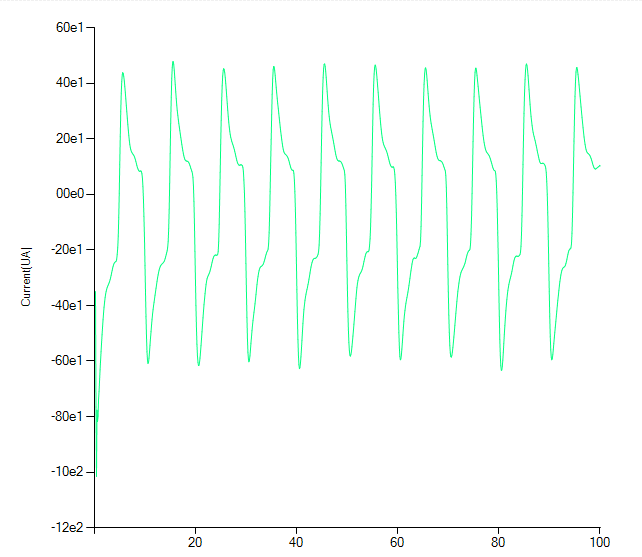
جمع آوری داده ها به این روش با استفاده از یک اسیلوسکوپ یا یک پلاتر که به عنوان ضبط کننده “نوار نمودار” کار می کند بسیار ساده است.
هنگامی که یک آزمایش الکترود کار دوگانه در حال انجام است، مانند ولتامتری حلقه-دیسک چرخشی، جریان های جاری در هر دو الکترود معمولاً نظارت می شوند. اسیلوسکوپ دیجیتال دوگانه یا پلاتر دو قلمی در این موارد مورد نیاز است.
سل الکتروشیمیایی از وسایل آزمایشگاه شیمی
انجام آزمایشهای الکتروشیمیایی نسبت به روشهای تیتریمتری، وزنی یا طیفسنجی نیاز به دقت بیشتری دارند.
ظروف شیشه ای تمیزتر، غلظت ها کمتر، الکترودها جلا داده شده و حلال ها خالص تر هستند.
آنچه در اینجا میآید شرحی از انواع دستگاهها و معرفهای شیمیایی مورد نیاز برای اکثر آزمایشهای ولتامتری است.
ظروف آزمایشگاه الکتروشیمی
در ساده ترین شکل خود، سلول الکتروشیمیایی، از جمله وسایل آزمایشگاه شیمی، یک تکه ظرف شیشه ای است که می تواند حجم مناسبی از محلول آزمایشی حاوی یک یا چند آنالیت الکترواکتیو را در خود نگه دارد.
سه الکترود (کار، مرجع و کمکی) در این محلول غوطه ور هستند که به صورت الکتریکی نیز به یک پتانسیواستات متصل هستند.
طرحهای ظروف شیشهای سفارشی که شامل اتصالات مناسب برای نصب الکترودها، ورودیها و خروجیهای گاز برای پاکسازی اکسیژن، روکشهای دما، و/یا محفظههای جداگانه برای هر یک از سه الکترود هستند، اغلب در محیطهای تحقیقاتی استفاده میشوند، اما ظروف شیشهای آزمایشگاهی معمولی نیز میتواند استفاده شوند.

هنگام انتخاب ظروف شیشه ای برای وسایل آزمایشگاه شیمی آموزشی، باید در نظر داشت که:
-
حجم محلول آزمایش چقدر است؟
-
آیا دانش آموزان به راحتی می توانند سلول را سوار کنند؟
-
در صورت وقوع حادثه، هزینه سل برای جایگزینی سلول چقدراست؟
فلاسک ته گرد سه گردنی از جمله وسایل آزمایشگاه شیمی یک قطعه شیشه ای ارزان قیمت و در دسترس است که می تواند به عنوان سلول الکتروشیمیایی استفاده شود. این فلاسکها میتوانند حجم قابلتوجهی از محلول را در خود نگه دارند و دهانههای گردنی آنقدر قطر دارند که اکثر الکترودها در آنها قرار میگیرند.
از هر دهانه روی فلاسک می توان برای نصب یکی از سه الکترود استفاده کرد.
این پیکربندی برای آزمایشهایی مناسب است که محلول آزمایش میتواند به طور ایمن در معرض اکسیژن هوا قرار گیرد و جداسازی هر الکترود در یک محفظه جداگانه لازم نیست.

هر زمان که پتانسیل متوسط منفی روی الکترود کار اعمال می شود، اغلب لازم است اکسیژن محلول از محلول آزمایش حذف شود زیرا در این پتانسیلها اکسیژن محلول کاهش پیدا می کند و جریان کاتدی نامطلوب حاصل ممکن است در اندازهگیری مورد نظر اختلال ایجاد کند.
یک راه حل معمولی برای این مشکل استفاده از سلولی است که به جز یک یا دو ورودی گاز و یک خروجی کوچک هوا را از خود عبور ندهد.
یک گاز بی اثر مانند نیتروژن در محلول وارد می شود تا هر گونه اکسیژن محلول را خارج کند. (معمولاً یکی از لوله های ورودی که مخصوصاً برای این منظور طراحی شده است، یک لوله مویین است که به انتهای محلول ختم می شود.)سپس در طول آزمایش، فضای هوای بالای محلول با عبور یک جریان ثابت از گاز بی اثر می شود.

فلاسک ته گرد چهار گردنی از دیگر وسایل آزمایشگاه شیمی را می توان برای حذف اکسیژن به صورت زیر پیکربندی کرد.
سه تا از دهانه ها برای نصب سه الکترود به صورت هوابند استفاده می شود. ( معمولاً آب بندی دهانه ها با پارافیلم کافی است.) سپس چهارمین دهانه با استفاده از سپتوم لاستیکی آب بندی می شود.
- یک سوزن سرنگ کوچک از طریق سپتوم نزدیک لبه بیرونی سپتوم وارد می شود. سپس، یک سوزن بسیار طولانیتر (که میتواند از طریق سپتوم به داخل محلول آزمایشی فشار داده شود) از مرکز سپتوم وارد میشود.
- گاز نیتروژن از طریق سوزن بلند به سلول منتقل می شود در حالی که سوزن کوچک به سادگی به عنوان خروجی عمل می کند. سوزن بلند ابتدا به داخل محلول فشار داده می شود و گاز نیتروژن در محلول حباب می کند. سپس، هنگامی که زمان انجام آزمایش فرا می رسد، سوزن بلند از محلول بیرون کشیده می شود (اما نه تا آخر سلول)، و سپس گاز نیتروژن محلول را می پوشاند.
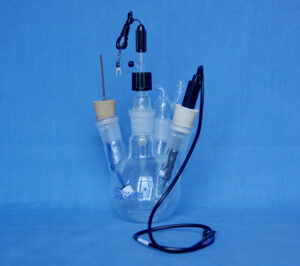
سل پنج دهانه : یک سلول مناسب از وسایل آزمایشگاه شیمی آموزشی، دارای پنج دهانه است. از سه تا از این دهانه ها می توان برای نصب الکترودهای کار، مرجع و کمکی استفاده کرد.

پایههایی نیز برای این سلول ها در دسترس هستند.
(شما میتوانید سل الکتروشیمیایی مورد نظر خود را از ما تهیه کنید.)
محلول آزمایش
محلول آزمایش در داخل سلول الکتروشیمیایی شامل یک یا چند آنالیت حل شده در محلول الکترولیت رسانا است. محلول الکترولیت معمولاً از غلظت (نسبتا) زیادی از نمک بی اثر الکتروشیمیایی حل شده در یک حلال فوق خالص تشکیل شده است.
خلوص حلال بسیار مهم است زیرا حساسیت اکثر تکنیک های ولتامتری به حدی است که حتی مقدار کمی از یک آلاینده الکترواکتیو نمایان می شود.
یافتن آنها با استفاده از سیستم های غیر آبی مبتنی بر حلال های آلی گرید HPLC که به شدت خشک شده و در برخی موارد سه بار تقطیر شده اند، غیر معمول نیست.
با این حال مربی یک آزمایشگاه آموزشی آکادمیک، احتمالاً علاقه بیشتری به صرفه جویی در زمان و هزینه های ممکن با استفاده از حلالی دارد که ارزان و به راحتی در دسترس است.
انتخاب واضح استفاده از آب است و آزمایشهای این کتابچه راهنمای استفاده از محلولهای الکترولیت آبی طراحی شدهاند.
اسیدها و بازهای با درجه معرف که تا سطوح غلظت مناسب رقیق شدهاند، حلالهای عالی برای الکتروشیمی هستند. به طور مشابه، بافرهای مختلف و محلول های نمکی بی اثر نیز ممکن است استفاده شوند. اما در همه موارد محلول باید از آب بسیار خالص تهیه شده و ظروف شیشه ای استفاده شده بسیار تمیز باشند.
این محلول های الکترولیت آبی در بسیاری از موارد با خلوص و سطوح الکترولیت مورد نیاز مستقیماً از تولید کنندگان عمده مواد شیمیایی در دسترس هستند.
برخی از مربیان (که برنامههای آزمایشگاهی بزرگ را اجرا میکنند) ممکن است متوجه شوند که سفارش دادن مقدار زیادی از محلول الکترولیت مورد نیاز و توزیع آن در بین دانشآموزان در صورت نیاز سادهتر است.
با این حال، در بسیاری از موارد، محلول های الکترولیت آبی باید «در داخل» یا توسط تکنسین آزمایشگاه یا توسط خود دانش آموزان تهیه شوند. در این موارد، داشتن منبع آب فوق خالص برای ساخت و رقیق کردن محلول ها بسیار مهم است.
اکثر برنامه های آزمایشگاهی تحلیلی در مقطع کارشناسی از نوعی منبع آب تصفیه شده استفاده گسترده ای می کنند. در حالی که این آب «خالص» حاصل از تقطیر تک مرحلهای منبع آب شهری محلی برای آزمایشهای طیفسنجی و تیتریمتری کاملاً کافی است، معمولاً برای ولتامتری مناسب نیست.
آب با بالاترین خلوص را میتوان از سیستمهای فیلتراسیون آب گرانتری که از ستونهای تبادل یونی استفاده میکنند به دست آورد، و مربیانی که به چنین سیستمهایی دسترسی دارند ممکن است این منبع آب را راحتتر بدانند.
با این حال، در محیطهای آکادمیک کوچکتر، احتمالاً صرفاً خرید آب دیونیزه، اولترافیلتر شده (DIUF) یا آب گرید HPLC از یک تولیدکننده عمده مواد شیمیایی مقرونبهصرفه است. اکثر سازندگان این آب فوقالعاده خالص را در مقادیر مختلف از جمله مقادیر 20 لیتری ارائه میدهند که برای استفاده در مقطع کارشناسی مناسب است.

الکترولیت پشتیبان موجود در محلول آزمایش الکتروشیمیایی برای افزایش رسانایی محلول در آنجا قرار می گیرد. این به کاهش بزرگی میدان الکتریکی در سراسر محلول آزمایش (توده) کمک می کند که به نوبه خود به حذف حرکت (ناخواسته) آنالیت تحت انگیزه این میدان کمک می کند. افت پتانسیل بین الکترودها در سلول مانند محلول های غیر رسانا باقی می ماند، اما الکترولیت اضافه شده باعث می شود که بیشتر افت پتانسیل در چند نانومتر از سطوح الکترود رخ دهد.
البته میدان الکتریکی در سراسر بخش عمده محلول هرگز به طور کامل حذف نمی شود، اما به طور کلی پذیرفته شده است که اگر غلظت الکترولیت پشتیبان حداقل صد (100) برابر بیشتر از غلظت آنالیت باشد، آنگاه اثر میدان الکتریکی در حرکت آنالیت را می توان با خیال راحت نادیده گرفت. در عمل، غلظت الکترولیت پشتیبان بین 0.1M و 1.0M است، به این معنی که غلظت آنالیت در آزمایشهای ولتامتری به ندرت از 0.01M تجاوز میکند.
انتخاب الکترولیت پشتیبان عموماً بر اساس دو سؤال است:
-
آیا در حلال مورد استفاده حل می شود؟
-
آیا از نظر الکتروشیمیایی در محدوده پتانسیل های مورد استفاده بی اثر است؟
هنگام استفاده از آب به عنوان حلال، یکی از بهترین انتخاب ها برای الکترولیت، نیترات پتاسیم (KNO3) است که کاملاً محلول و از نظر الکتروشیمیایی بی اثر است.
ممکن است از کلرید پتاسیم (KCl) استفاده شود، اما یون کلرید در پتانسیلهای مثبت بیشتر مستعد اکسیداسیون است.
محلول های اسیدهای قوی یا بازهای قوی در غلظت های مولی نزدیک نیز به دلیل رسانایی بالا، حلال های خوبی برای الکتروشیمی هستند.
سودمندی محلول های اسیدی به طور کلی با کاهش یون هیدرونیوم در پتانسیل های منفی محدود می شود.
تهیه محلول های رقیق
مربی آزمایشگاه در هنگام فکر کردن به اینکه چگونه می تواند معرف های لازم و حلال های خالص را برای یک آزمایش الکتروشیمیایی به دانش آموزان ارائه دهد، کمی دچار تردید می شود.
با توجه به هزینه ها و مشکلات مربوط به دستیابی به یک حلال به اندازه کافی خالص و هزینه دفع زباله های خطرناک، منطقی به نظر می رسد که دانش آموزان از حداقل حجم حلال هنگام تهیه محلول ها استفاده کنند.
اما از آنجایی که غلظت آنالیت در آزمایشهای ولتامتری کاملاً رقیق است (کمتر از 0.01M)، دانشآموز مجبور میشود از حجم زیادی حلال یا چند مرحله رقتسازی استفاده کند.
مثالی ارائه می شود که این موضوع را نشان می دهد. اگر آزمایشی از دانشآموز بخواهد که 100 میلیلیتر از محلول 0/5 میلیمولار آنالیت با جرم فرمول 0/300 گرم بر مول را به طور کمی تهیه کند، آنگاه دانشآموز و/یا مربی میتوانند یکی از سه راهبرد آمادهسازی زیر را انتخاب کنند، که هر کدام از آنها دارای مزایا و معایب مرتبط با آن:
- 0.1500 گرم از آنالیت را به طور دقیق در یک فلاسک حجمی 100 میلی لیتری وزن کنید و سپس با استفاده از محلول الکترولیت خالص “تا خط” رقیق کنید. یک گروه ده نفره از دانش آموزان که هر کدام به تنهایی کار می کنند، با استفاده از این گزینه فقط یک لیتر محلول الکترولیت مصرف می کنند.
- 1.500 گرم از آنالیت را به طور دقیق در یک فلاسک حجمی 1000 میلی لیتری وزن کنید و سپس با استفاده از محلول الکترولیت خالص “تا خط” رقیق کنید. یک گروه ده نفره از دانش آموزان که هر کدام به تنهایی کار می کنند، ده لیتر محلول الکترولیت را با استفاده از این گزینه مصرف می کنند.
- مربی با وزن کردن دقیق 7.500 گرم آنالیت در یک فلاسک 500 میلی لیتری و رقیق کردن “تا خط” با محلول الکترولیت خالص، محلول “ذخیره” را تهیه می کند. سپس هر دانشآموز 00/10 میلیلیتر از محلول موجود را در یک فلاسک حجمی 100 میلیلیتری پیپت میکند و با استفاده از محلول الکترولیت خالص «تا خط» رقیق میشود. یک گروه ده نفری از دانشآموزان که هر کدام به تنهایی کار میکنند، با استفاده از این گزینه فقط 1.5 لیتر محلول الکترولیت مصرف میکنند.
استراتژی اول از حداقل حجم محلول الکترولیت گران قیمت استفاده میشود در حالی با تنها یک مرحله رقت دقت بالاتر است.
با این حال، برای تهیه محلول با دقت مورد نیاز، باید ترازویی با قابلیت اندازهگیری مقادیر کم در دسترس باشد.
هزینه میکروبالانس های دیجیتال در سال های اخیر کاهش یافته است، به طوری که این گزینه ممکن است به زودی به طور گسترده در دسترس باشد.
استراتژی دوم دقت مربوط با توجه به یک مرحله رقیق سازی را حفظ می کند، اما نیازی به میکروبالانس ندارد. متاسفانه اگر هر دانش آموز محلول جداگانه ای تهیه کند این گزینه نه لیتر محلول الکترولیت را هدر می دهد! بدیهی است که اگر کل گروه ده دانش آموز از همان دسته یک لیتری محلول استفاده کنند، هیچ ضایعاتی وجود نخواهد داشت، اما هیچ پاسخگویی نیز از سوی هر دانش آموز در مورد صحت نتایج آزمایشی وجود نخواهد داشت.
آخرین استراتژی احتمالاً بهترین گزینه برای زمانی است که هیچ ترازویی با دقت بالا در دسترس نباشد اما مربی تمایل دارد که دانشآموز در ساخت محلول مشارکت داشته باشد. در این شرایط از حجم قابل قبولی محلول الکترولیت استفاده می کند و همچنان هر دانش آموز را ملزم به تهیه محلول های جداگانه می کند. عیب اصلی این است که مربی باید محلول استوک (محلول مادر) را زودتر از موعد آماده کند.

انتخاب الکترود
انواع الکترودهای مورد استفاده در آزمایشگاه شیمی شامل موارد زیر هستند:
الکترود کار
الکترود مرجع
الکترود کمکی
شما میتوانید در مقاله الکترود کار، کمکی و رفرنس در مورد هر کدام از این الکترود ها اطلاعات بیشتری به دست بیاورید.
محافظ الکتریکی جزو وسایل آزمایشگاه شیمی
جریان های کوچک مشاهده شده در برخی از آزمایشات الکتروشیمیایی در معرض تداخل نویز الکتریکی در محیط آزمایشگاه هستند.
برای کمک به محافظت از آزمایش در برابر نویز، ایده خوبی است که از کابل کواکسیال برای ایجاد تمام اتصالات از الکترودها به پتانسیواستات استفاده کنید و در صورت استفاده از پلاتر، اتصالات بین آن و پتانسیواستات نیز باید از کابل کواکسیال استفاده شود. این اقدامات ساده معمولاً نویز را تا حد ناچیز کاهش می دهد.
هنگام استفاده از الکترودهای بسیار کوچک یا غلظتهای کم آنالیت، این احتمال وجود دارد که جریان مشاهدهشده در الکترود کار به ترتیب نانوآمپر به پیکوآمپر باشد.
هنگام اندازهگیری چنین جریانهای کوچکی، معمولاً لازم است که کل سلول را در داخل یک قفس فلزی قرار دهیم تا سلول را از محیط پر سر و صدا آزمایشگاه محافظت کند.
گاهی اوقات قفس فارادی نامیده می شود، قفس فلزی باید به همان نقطه ای متصل شود که پتانسیواستات و دستگاه خروجی زمین هستند.
مقدار نامناسب نویز را اغلب می توان در الکترود مرجع ردیابی کرد.
از آنجایی که الکترود مرجع لزوماً امپدانس بالایی دارد، می تواند به عنوان آنتنی برای دریافت نویز الکترونیکی عمل کند. همچنین، حبابها یا فرورفتگیهای مسدود شده در الکترود مرجع، بهویژه منابع رایج نویز هستند.


