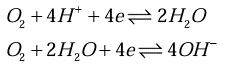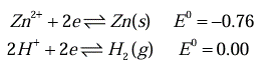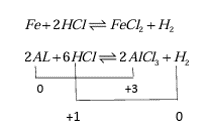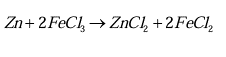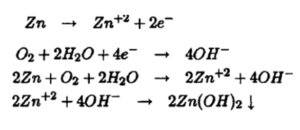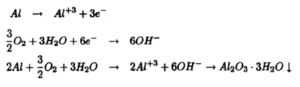خوردگی
خوردگی چیست
- خوردگی:
تخریب یا فاسد شدن یک ماده در اثر واکنش با محیطی که در آن قرار دارد را خوردگی گویند.
- محیط خورنده:
محیط های خورنده مانند محلول های آبی،اتمسفر،آب دریا،محلول های اسیدی،خاک،آتش،هوا و رطوبت و..است.
نمونه هایی از خوردگی:
در فلزات:
در نا فلزات:
پیامدهای خوردگی
مستقیم
- مخارج تعمیر و نگهداری
- شکل ظاهری
غیر مستقیم
- توقف فعالیت کارخانه یا قسمتی از آن
- نشت و از بین رفتن محصولات با ارزش
- کاهش راندمان تولید محصول
- آلوده شدن محصول،محیط، گاز سمی
- طراحی اضافی
مفاهیم پایه در خوردگی
- آند:
آند الکترودی است که گونه در آن اکسید می گردد و الکترون تولید میکند، آند چشمه الکترون است و در پیل گالوانی علامت آن (-) است.
- کاتد:
کاتد الکترودی است که عمل کاهش روی آن انجام میشود و الکترون مصرف میکند، در پیل گالوانی علامت آن (+) است.
- الکترولیت:
الکترولیت محلول هادی الکتریسیته است(محلول نمکی).
- مسیررسانای فلزی:
دو الکترود به وسیله یک فلز هادی به یکدیگر متصل میشوند و الکترون از قطب – به قطب + حرکت میکند.
نمونه واکنش الکتروشیمیایی
[جهت آشنایی با واکنش های الکتروشیمیایی پیشنهاد میشود مقاله سری الکتروشیمیایی عناصر را مطالعه کنید همچنین پس از آن پیشنهاد میگردد از مقاله پل نمکی نیز بازدید کنید.]
جنبه های الکتروشیمیایی خوردگی
اگر دوقطعه فلزی مختلف یا یکسان درون یک الکترولیت قرار بگیرند و این دو قطعه از طریق الکترولیت حامل یون، ارتباط یونی داشته باشند:
-
آن بخش از سطح فلز که از آنجا جریان الکتریسیته فلز را به طرف دیگر محلول ترک میکند(تولید الکترون میکند) آند می گویند.
-
در مقابل بخشی از سطح فلز که از آن قسمت جریان محلول را ترک میکند(الکترون مصرف میکند) را کاتد می گویند.
واکنش های آندی
آند ناحیه ای است که فلز از بین می رود. واکنشی که در آند رخ می دهد یک واکنش اکسیداسیون می باشد.
این واکنش نشان دهنده ورود یون های فلزی به داخل محلول است وممکن است با حل شدن، هیدراسیون ویا حالتی پیچیده انجام شود. این عمل همچنین شامل جدایش یون فلزی از سطح فلز می باشد.
مشخصات واکنش های آندی
- واکنش های اکسیداسیون با یونی که دارای بار است انجام میشود.
- د این واکنش ها الکترون آزاد میشود.
- در اغلب فلزات مراحل اکسیداسیون نشان دهنده خوردگی هستند و زمانیکه اکسیداسیون متوقف شود خوردگی هم متوقف می شود.
واکنش های کاتدی
- این واکنش ها در کاتد رخ میدهد و از نوع واکنش های احیایی هستند. الکترون هایی که از آند آزاد شده اند طی واکنش هایی در کاتد مصرف میشوند.
- بر خلاف واکنش های آندی در اینجا واکنش ها همراه با کاهش ظرفیت هستند.
الکترولیت
الکترولیتی که به صورت یک محیط خورنده عمل میکند هر محلولی میتواند باشد.
- رطوبت هوا
- آب نمکی
- محلول اسیدی
- محلول بازی
- باران
مثالی از خوردگی
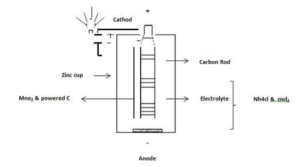
- در یک باتری قلمی خشک رایج ترین نوع خوردگی الکتروشیمیایی رخ میدهد. در این باتری به دلیل خوردگی گالوانیکی، جریان الکتریکی تولید می شود. زمانی که فلز روی در آند کاملا خورده می شود،عملا باتری تخلیه می شود.
- میخ آهنی در هوای مرطوب (محیط خورنده) خود به خود خورده می شود.

- زنگ زدن تیر آهن

اگر کاتد وجود نداشته باشد، خوردگی در قسمت آند رخ نمی دهد.
این دو واکنش در یک لحظه و با سرعت یکسان رخ می دهند.
سوال
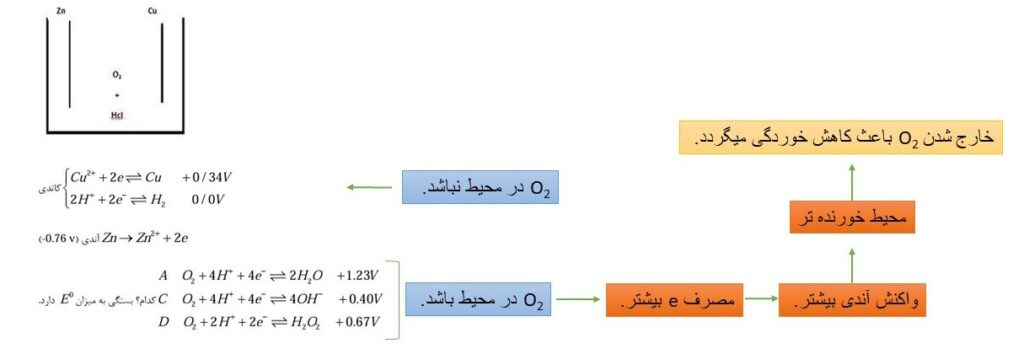
- اگر یک قطعه فلز Zn در محلول HCl قرار بگیرد، آیا خورده میشود؟
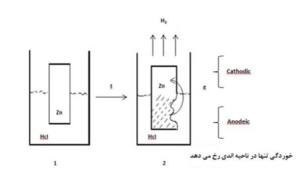
قسمتی از فلز روی که در درون محلول HCl قرار گرفته است خورده می شود. و در نقاطی که فلز روی بدون تغییر باقی مانده است خوردگی اتفاق نیافتاده است زیرا خود به خود نقش کاتد به خود گرفته است.
بررسی فرآیند آندی در خوردگی
هنگامی که در آند اکسایش رخ می دهد، اتم با بار مثبت (+M2) سطح فلز را ترک کرده و e ها برای سطح فلز باقی می ماند و بارسطح منفی شده و در صورت وجود یک مدار خارجی این بار منتقل می شود.
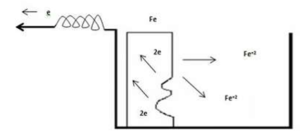
بررسی فرایند کاتدی در خوردگی
e های تولید شده در آند، از طریق مدار خارجی به کاتد رسیده، و برای موازنه بار e ها به یون های اطراف منتقل می شود. در مثال قبل تر در کاتد e به +H محلول داده می شود و الکترولیت اسیدی (HCl) گاز H2 را طی واکنش زیر آزاد می کند.
2H++2e→ H2
علاوه بر واکنش کاتدی ذکر شده در یک محیط اسیدی خوردنده، واکنش های کاتدی دیگری نیز بسته به شرایط الکترولیت می تواند رخ دهد.
مثلا اگر ظرف واکنش سر باز باشد و اکسیژن حل شده درون آن زیاد باشد، حضور اکسییژن سبب انجام واکنش های کاتدی زیرعلاوه بر واکنش اصلی احیا هیدروژن خواهد شد.
وجود اکسیژن به علت افزایش میزان مصرف الکترون در کاتد و افزایش انجام واکنش در آند سبب افزایش میزان خوردگی می شود.به همین دلیل است که در محیط مرطوب به علت وجود اکسیژن خورده شدن همیشه اتفاق می افتد.
سوال: کدام واکنش انجام می شود؟
- دو قطعه فلزی نشان داده شده در تصویر با یک اتصال در یک محیط اسیدی هستند، چه واکنشی انجام می شود؟
Zn اکسایش می یابد و خورده میشود و واکنش کاتدی با توجه به محیط و E0 انجام می شود.در ادامه جزئیات واکنش را بررسی میکنیم.
پلاریزاسیون در خوردگی
واکنش های شیمیایی ابتدا سرعت زیادی دارندسپس کم کم کند شده و به یک سرعت ثابت می رسند، واکنش های خوردگی نیز همینطور است.
اگر محصول حاصل از واکنش (مانند گاز H2 تولید شده در اطراف کاتد در محیط های خورنده اسیدی) در واکنش کاتدی مصرف نشود، غلظت این محصول در اطراف کاتد زیاد شده و کم کم واکنش کاتدی کند می شود و پلاریزاسیون رخ میدهد.
2H++2e→ H2
{پیشنهاد میشود مقاله انتقال جرم و همرفت را مطالعه کنید.}
اهمیت اکسیژن در پلاریزاسیون خوردگی
اکسیژن یک عامل خورنده و کاهش دهنده میزان پلاریزاسیون(برای واکنش کاتدیک) است.
اکسیژن با انجام واکنش های کاتدی متنوع در موارد زیر نقش دارد.
-
تشکیل چند محصول کاتدی که باعث گسترش واکنش کاتدی میگردد.
-
مانع کند شدن واکنش خوردگی شده و به تداوم واکنش کاتدی کمک میکند.
بنابراین اکسیژن به روش زیر میزان خورده شدن در واکنش فوق را افزایش میدهد:
-
مصرف e با انجام سه واکنش A C D
-
مصرف +H با انجام سه واکنش A C D
-
کاهش غلظت H2 تولیدی که در نتیجه واکنش کاتدی H2 پیش رفته , پلاریزاسیون کم می شود.
جدول پتانسیل خوردگی فلزات
اندازه گیری پتانسیل یک فلز یا الکترود درحال خورده شدن به بررسی موارد زیر کمک میکند :
- میزان خوردگی
- سرعت خوردگی
- راه های کاهش خوردگی
اندازه گیری پتانسیل فلز در حال خورده شدن با یک الکترود مرجع انجام میشود.الکترودهای مرجع مانند:
- کالومل اشباع : Hg/Hg2Cl2 ,KCl
- استاندارد هیدروژن SHE
به پتانسیل Red-Oxe نسبی یک واکنش الکتروشیمیایی تحت تعادل (جریان صفر) گفته می شود. که از روی E0 یا E حاصل از رابطه نرنست به دست می آید. مقادیر E0 در جدول الکتروشیمیایی عناصر مشخص شده است.
سوال:
- فلز روی (Zn) در محیط اسیدی خورده میشود؟ (فرض کنید یک تانک از جنس فلز روی قرار است ساخته شود تا به عنوان مخزن نگهداری اسید استفاده شود)
تمامی گونه هایی که پتانسیل آن ها منفی باشد در محیط اسیدی خورده میشوند.روی در محیط اسیدی تمایل به خوردگی دارد و نمیتوان مخازن مورد استفاده در محیط اسیدی را از جنس روی ساخت.
سوال
چرا فلز مس (Cu) در محیط های اسیدی محتوی اکسیژن خورده می شوند اما Au حتی در محیط های اسیدی تنها یا اسیدی حاوی اکسیژن نیز پایدارند و خورده نمیشوند؟
با توجه به مقادیر E0 و در نظر گرفتن اینکه پتانسیل منفی تر تمایل بیشتری به اکسایش دارد:
- Au، مقدار E0 مثبت تری از واکنش های حاوی +2H و O2 دارد ⇐ خورده نمی شود.
- Cu درعدم حضور اکسیژن، E0 مثبت تری از واکنش+2H دارد ⇐ خورده نمی شود.
- Cu در حضور اکسیژن،E0 منفی تری از واکنش های حاوی +2H و O2 دارد ⇐ خورده می شود.
رویین شدن و تشکیل فیلم های محافظ
به محض قرار گرفتن بیشتر فلزات در معرض هوا، ممکن است یک لایه نازک یا فیلم اسیدی به صورت طبیعی تشکیل شود که می تواند حفاظت قابل ملاحظه ای در برابر حملات خوردگی ایجاد کند.در نتیجه سرعت خورده شدن به علت تشکیل لایه محافظ کاهش می یابد.
مثال:
1.اگر تشکیل لایه محافظ نبود Ca، Mg و Al به سرعت در آب خورده میشدند در حالی که در واقعیت اینطور نیست.
2.اسکله دریایی از جنس Cu غوطه ور در محلول نمکی حاوی O2، به دو دلیل خورده نمی شود:
- تشکیل لایه محافظ
- شوری آب دریا:
(یون کلراید موجود ) به علت جاذبه الکترو استاتیک دورتا دور فلز را احاطه کرده و به عنوان یک لایه محافظ عمل می کند.یون های دیگر مانند سولفات،فسفات و..نیز میتوانند به عنوان لایه محافظ عمل کنند.
اثر اکسیژن بر خوردگی:
- به علت انجام واکنش های کاتدی میزان خورده شدن را تشدید میکند.
- به علت داشتن E0 مثبت، سبب خوردگی اکثر گونه ها با E (–) می شود.
- با ترکیب شدن با فلز میتواند لایه محافظ تشکیل دهد و میزان خوردگی را کاهش دهد.
بررسی محیط خوردگی
خوردگی ممکن است در سه محیط انجام گردد:
-
محیط اسیدی
-
محیط خنثی
-
محیط بازی
محیط اسیدی
درمحیط اسیدی هرگاه فلزی خورده شود (اکسایش یابد) در واکنش کاتدی گاز H2 آزاد می گردد.
محیط خنثی و قلیایی
خوردگی فلزات میتواند در آب دریا محلول های نمکی و قلیایی رخ دهد.محلول های آبی به سرعت O2 را از هوا گرفته و در خود حل می کند.همچنین در اکثر سیستم ها خوردگی فقط در حضور O2 رخ میدهد.
سایر سیستم ها
در بعضی اوقات در عدم حضور محلول های خورنده (محیط خورنده) O2 و H2o و HCl و…نیز امکان خورده شدن وجود دارد،به شرطی که تغییر عدد اکسایش وجود داشته باشد.
محصولات خوردگی
یک راه برای تشخیص اتفاق افتادن خوردگی بررسی محصولات آن است.
- محصولات خوردگی در محلول حاوی یون های –Cl و–SO42 برای یک گونه فلزی مانند Zn می تواند شامل ZnSO4 و ZnCl2 باشد.باحضور این محصولات میتوان به محیط خورنده سولفریک اسیدی یا هیدروکلریدی پی برد.
- محصولات خوردگی جامد مانند اکسیدها و هیدروکسیدها برای مثال هیدروکسید آهن Fe(OH)3 نشان دهنده وجود محیط خنثی و اکسیژن است.
سنجش و پایش میزان خوردگی
- هنگامی که خوردگی اتفاق می افتد گاه موجب افزایش و گاه کاهش وزن می شود.
عوامل موثر بر خوردگی فلزات
- میزان سطح در تماس
- طول مدت زمان
عوامل ارزیابی کننده میزان خوردگی
- تغییر وزن:
نشان دهده میزان کاهش یا افزایش میزان وزن بر واحد سطح نسبت به زمان است( واحد اندازه گیری رایج Mdd).
- تغییر ابعاد:
به صورت کاهش میزان ضخامت فلز در واحد زمان بیان میشود(میکرومتر در سال Um/Yو یا میلیمتر در سال mm/y).
- تغییر در خواص مکانیکی:
میزان کاهش فلزات در مقاومت کششی، Punctility میتواند نشانه ای از خوردگی باشد.
محاسبه سرعت خوردگی
- جهت بررسی عمر تجهیزات بررسی سرعت خوردگی اهمیت دارد.
انواع سلول های خوردگی
-
سلول های گالوانی
-
سلول های غلظتی
-
سلول های الکترولیتی
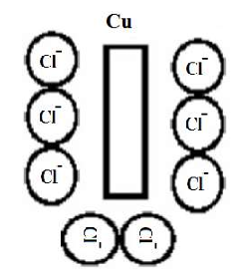
سلول های گالوانیکی
در این سلول آند و کاتد از دو فلز غیر مشابه و یک الکترولیت (عموما نمک همان فلز در شرایط غیر مشابه) وجود دارد.
مثال:
الکترود آهن و مس که در الکترولیت قرار داده شده اند:
- اهن به عنوان آند عمل میکند
- مس به عنوان کاتد عمل میکند
سلول های غلظتی
شبیه سلول های گالوانیکی است اما در این حالت فلز در الکترولیت نا همگن قرار می گیرد.
مثال:
- عموما این امر عموما در تجهیزات زیرزمینی مشاهده شده است مانند خوردگی یک لوله در خاک.
سلول های غلظتی را میتوان باتوجه به موارد زیر تنظیم کرد:
-
تغیرات اکسیژن در خاک
-
تفاوت در میزان رطوبت خاک
-
تفاوت در ترکیب خاک
تفاوت غلظت باعث ایجاد اختلاف پتانسیل در اطراف آند می شود.
-
ناحیه غلیظ تر آند
-
ناحیه رقیق تر کاتد
سلول های الکترولیتی
در این سلول (که می تواند سلول گالوانی یا غلظتی باشد) یک جریان خارجی به سیستم اعمال می شود.
-
آند قطبیت +
-
کاتد قطبیت -
از این سلول ها جهت حفاظت سازه ها در برابر خوردگی استفاده می شود.(حفاظت کاتدی)
[جهت مطالعه بیشتر در خصوص سلول های الکتروشیمیایی کلیک کنید.]
مکانیزم زنگ زدن در آهن
قطعه ای از آهن که در معرض هوای مرطوب (الکترولیت) قرار دارد را در نظر بگیرید:
- +Fe2 از آند آزاد می شود.
- با عمل احیا یون –OH در کاتد روی سطح فلز ایجاد می شود.
یونهای مثبت و منفی ترکیب شده و واکنش زیر انجام می شود:
Fe2++2OH–→Fe(OH)2
Fe(OH)2 با نام زنگ آهن در آب نا محلول است و از الکترولیت جدا می شود.
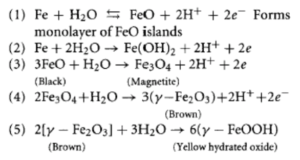
خوردگی فلز روی
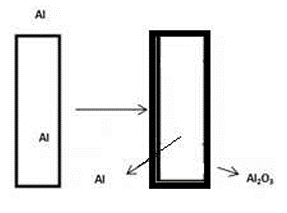
خوردگی آلومینیوم
رفرنس:
کتاب مهندسی خوردگی فونتانا،دکتر احمد ساعتچی
کتاب خوردگی زکی احمد ترجمه یوسف اکبری