پل نمکی
در این مقاله، پل نمکی، کاربرد و نقش آن در سلولهای شیمیایی، انواع، محدودیت ها و .. را به تفصیل بررسی خواهیم کرد.
پل نمکی چیست
پلنمکی (salt bridge) برای عملکرد مناسب سلولهای الکتروشیمیایی مانند سلولهای ولتایی یا سلولهای دانیل ضروری است. از آنها در یک سلول الکتروشیمیایی برای اتصال نیم سلول های اکسیداسیون و احیا استفاده می شود و معمولاً از یک الکترولیت قوی تشکیل شده است.
وظیفه اصلی پل نمکی
-
محلول های دو طرف یک سلول الکتروشیمیایی را خنثی نگه می دارد.
-
از اختلاط بین محلول های دو طرف سلول جلوگیری می کند.
-
پتانسیل اتصال بین فصل مشترک محلول دو نیم سلول را کاهش می دهد .
- حفظ خنثی بودن الکتریکی
پل نمکی از تجمع بارهای مثبت یا منفی در الکترودها جلوگیری می کند و محلول را خنثی نگه داشته و از اختلال در واکنش الکتروشیمیایی جلوگیری می کند تا جریان الکتریکی بتواند به تولید ادامه دهد.
بدون پل نمکی، بار منفی فقط در یک طرف سلول الکتروشیمیایی جمع میشود و طرف دیگر دارای بار مثبت میشود تجمع بار در هر دو نیم سلول وضعیت نامطلوبی است زیرا طبیعت می خواهد سیستم هایی را که خنثی هستند حفظ کند. اگر این بار به تجمع خود ادامه دهد، واکنش الکتروشیمیایی را مهار می کند و از رسیدن آن به حد کامل جلوگیری می کند.
- جلوگیری از پتانسیل اتصال مایع
پتانسیل اتصال مایع پتانسیلی است که بین دو محلول در تماس با یکدیگر ایجاد می شود. پل نمکی پتانسیل اتصال مایع به مایع را به حداقل می رساند،
هرگونه تجمع بار در محلول های دو نیم سلولی به عنوان پتانسیل اتصال شناخته می شود . بنابراین، هدف از پل نمکی کاهش پتانسیل اتصال بین فصل مشترک محلول دو نیم سلول است.پل نمکی به عنوان یک منبع یونهای تماشاگر عمل می کند و برای حفظ خنثی بودن می تواند به هر یک از نیمسلولها مهاجرت کند.
چگونگی عملکرد پل نمکی
فرآیندی را که در هر یک از نیم سلولهای شکل زیر انجام میشود در نظر بگیرید.
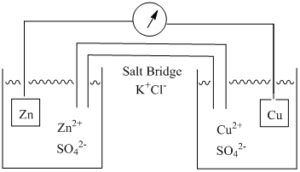
اگر هر نیمسلول از شرایط حالت استاندارد شروع کند:
- کاتد ابتدا دارای غلظت 1 مولار نمک مسی مانند سولفات مس: ([+Cu2] = 1 M؛ [–SO 4 2] = 1 M)
- و آند دارای نمک روی، مانند سولفات روی ([+Zn 2] = 1 M؛ [–SO 4 2 ] = 1 M) خواهد بود.
توجه کنید که در هر دو نیمسلول، یون سولفات یک یون تماشاگر است که در واکنش الکتروشیمیی شرکت نکرده و تغییری نمیکند.
همانطور که واکنش الکتروشیمیایی ادامه می یابد:
- +Cu2 در کاتد کاهش می یابد و به فلز مس تبدیل می شود.
- در نیمه دیگر، فلز روی اکسید می شود و +Zn 2 را تشکیل می دهد .
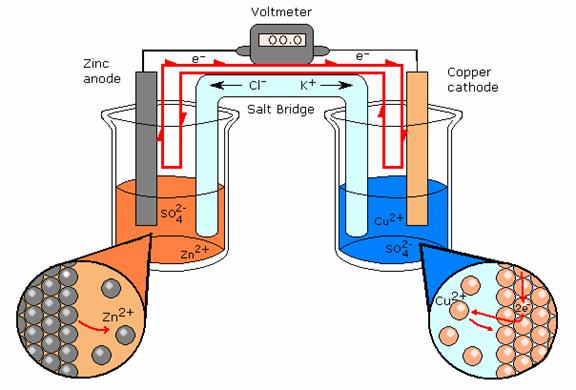
با گذشت زمان مقایسه غلظتها به شرح زیر است:
- در کاتد: [+Cu2 ] < [–SO 4 2 ]
- در آند: [+Zn 2] > [–SO 4 2 ]
تجمع بار در هر دو نیم سلول وضعیت نامطلوبی است زیرا طبیعت می خواهد سیستم هایی را که خنثی هستند حفظ کند. اگر این بار به طور مداوم تجمع یابد، باعث مهار واکنشهای الکتروشیمیایی میشود و از رسیدن آن به حداکثر ممکن جلوگیری میکند.
هدف از پل نمکی این است که به عنوان منبع یون های تماشاگر عمل کند که می تواند به هر یک از نیم سلول ها برای حفظ بی طرفی مهاجرت کند. به منظور حفظ خنثی بودن:
- یون های دارای بار منفی در پل نمکی به نیمه سلول آندی مهاجرت می کنند.
- در سلول کاتدی نیز به طور مشابه (اما معکوس) این اتفاق رخ میدهد.
محتوای پل نمکی شیمی
-
گونه های یونی ای در پل نمکی قرار میگیرد که در هیچ یک از نیم سلول ها احیا یا اکسید نشوند.
کاتیون های قلیایی و آنیون های هالیدی برای این منظور ایده آل هستند.
-
تعادل بار در هر یک از نیمسلولها به وسیله یونهای حاضر در پل نمکی باید با سرعت یکسانی انجام شود.
این بدان معناست که آنیونهای هالید که از پل نمکی به داخل آند حرکت میکنند تا یونهای +Zn 2 اضافی را متعادل کنند با کاتیونهای قلیایی که از پل نمکی به داخل کاتد حرکت میکنند تا تخلیه +Cu2 را متعادل کنند، سرعت حرکت یکسانی دارند.
یون ها دارای خاصیتی به نام تحرک هستند و تحرک یک یون به اندازه یون بستگی دارد:
- یونهای کوچکتر از یونهای بزرگتر تحرک بیشتری دارند.
این بدان معناست که گونه ایده آل برای پل نمکی باید دارای کاتیون و آنیون با اندازه و بار یکسان باشد.
- کلرید پتاسیم گونه ایدهآل برای ادغام در یک پل نمکی است، زیرا +K و –Cl تعداد الکترونهای یکسانی دارند و تقریباً به یک اندازه هستند.
- همچنین پتاسیم نیترات (KNO3) نیز می تواند در پل نمکی استفاده شود. به طور شگفت انگیزی، یون نیترات که دارای اتم هایی با الکترون های لایه دوم است، تقریباً به اندازه یک یون کلرید با الکترون هایی در لایه سوم است.
-
نکته دیگری که باید در نظر گرفت غلظت گونه در پل نمکی است.
داشتن پل نمکی ای که بتواند بر احتمال تجمع بار زیاد غلبه کند، مطلوب است. برای رسیدن به این هدف و عدم تخلیه یونهای موجود در پل نمک در طول واکنش، گونه (مثلا KCl) معمولاً در غلظت بالایی است، معمولاً 4 M.
انواع پل نمکی در الکتروشیمی
دو نوع اصلی از salt bridge مورد استفاده در سلول های الکتروشیمیایی وجود دارد که عبارتند از:
-
پل های نمکی لوله شیشه ای
-
فیلتر کاغذ به عنوان پل نمکی
1.پل های نمکی لوله شیشه ای
در این نوع، یک لوله شیشهای U شکل حاوی الکترولیت نسبتاً بی اثر مانند کلرید سدیم (NaCl)، کلرید پتاسیم (KCl) یا نیترات پتاسیم (KNO3)، بین دو محیط الکترولیتی قرار میگیرد تا یونها بتوانند از یک نیمه به نیمه دیگر حرکت کنند.
-
الکترولیت باید با سایر مواد شیمیایی در سلول واکنشپذیری نداشته باشد.
-
کاتیونها و آنیونها باید با سرعتهای مهاجرت مشابه (بار یون مقایسهپذیر و وزن مولکولی مشابه) باشند.
-
الکترولیتها اغلب به صورت ژل نگه داشته میشوند، مانند آگار آگار.
عوامل موثر بر رسانایی:
- غلظت محلول
- قطر لوله شیشه ای
وقتی که غلظت محلول نمکی کاهش مییابد، تعداد یونهای حاضر در محلول نیز کاهش مییابد، که این باعث کاهش رسانایی محلول میشود. به علاوه، افزایش قطر لوله شیشهای باعث افزایش مساحت مختلط و سطح تماس بین محلولهای موجود در دو نیمسلول میگردد، که این افزایش منجر به افزایش رسانایی محلول نمکی میشود.

۲. پل نمکی با صافی
در این نوع پل نمکی، یک ماده جاذب رطوبتی مانند پلیمر به محلول نمکی اضافه شده و بین دو نیمهی سل قرار میگیرد. این فیلتر از عبور یونها و اختلاط دو الکترولیت با یکدیگر جلوگیری میکند.
کاغذ متخلخل، مانند کاغذ صافی، اگر در الکترولیت مناسب خیسانده شود، می تواند به عنوان پل نمکی استفاده شود. رسانایی این نوع پل به عواملی مانند غلظت الکترولیت، تخلخل و زبری کاغذ صافی بستگی دارد.
ساخت پل نمکی
پل نمکی را می توان با دنبال کردن روش زیر ساخت:
مواد مورد استفاده در پل های نمکی
برای ساخت پل نمکی می توانید از مواد زیر استفاده کنید:
کاغذ صافی: کاغذ صافی به دلیل تخلخل و قابلیت جذب محلول های الکترولیت، ماده مورد استفاده رایجی است. اغلب در محلول یک الکترولیت ضعیف مانند کلرید پتاسیم (KCl) یا نیترات پتاسیم (KNO3) خیسانده می شود تا امکان مهاجرت یون ها در عین حفظ شدن تعادل الکتریکی فراهم شود.
لوله شیشه ای U شکل: یک لوله شیشه ای U شکل نیز می تواند به عنوان ماده پل نمکی استفاده شود که با یک الکترولیت بی اثر، مانند کلرید پتاسیم (KCl) یا نیترات پتاسیم (KNO3) پر شده است تا امکان مهاجرت یون ها در عین حفظ خنثی بودن الکتریکی را فراهم کند.
مواد متخلخل: سایر مواد متخلخل بی اثر نیز می توانند به عنوان مواد پل نمکی استفاده شوند. این مواد باید در محلول الکترولیت ضعیف خیسانده شوند تا امکان مهاجرت یونها و حفظ خنثی الکتریکی فراهم شود.
مراحل مونتاژ
مراحل معمول در مونتاژ شامل موارد زیر است:
مواد را آماده کنید: یک ماده مناسب مانند کاغذ صافی، لوله شیشه ای U شکل یا سایر مواد متخلخل بی اثر را انتخاب کنید.
خیساندن مواد در الکترولیت: مواد انتخاب شده را در محلولی از یک الکترولیت ضعیف مانند کلرید پتاسیم (KCl) یا نیترات پتاسیم (KNO 3 ) خیس کنید تا امکان مهاجرت یون ها در عین حفظ خنثی بودن الکتریکی فراهم شود.
مونتاژ کنید: هنگامی که مواد خیس شد، پل نمکی را جمع کنید تا مطمئن شوید که برای استفاده در سلول الکتروشیمیایی آماده است.
تاثیر پل نمکی بر پتانسیل سلول
غلظت نمک در پل نمکی میتواند تأثیر کمی بر پتانسیل سلولی داشته باشد. در حالی که خود پل نمکی مستقیماً بر ولتاژ کلی یک نیم سلول تأثیر نمی گذارد و نقش مهمی در حفظ ولتاژ ثابت و جلوگیری از تجمع بارهای مثبت و منفی در اطراف الکترودها دارد. پل نمکی به حفظ بیطرفی الکتریکی در مدار داخلی کمک میکند و جریان مداوم الکترونها را امکانپذیر میکند.
پل نمکی در سلول های الکترولیتی
در سلول های الکترولیتی، پل نمکی وجود ندارد و الکترودها در یک محلول الکترولیت معمولی بدون پل نمکی قرار دارند.
در الکترولیز، اختلاط الکترولیت ها مجاز است، بنابراین نیازی به پل نمکی برای جلوگیری از اختلاط الکترولیت نیست. و عدم وجود آن بر واکنش الکتروشیمیایی تأثیر نمی گذارد، زیرا محلول الکترولیت خود به عنوان یک رسانا عمل می کند.
تفاوت بین پل نمکی در سلول الکترولیتی و سلول گالوانیکی
- سلول گالوانی از ظروف مختلف تشکیل شده است که از طریق یک پل نمکی یا پارتیشن متخلخل به هم متصل می شوند
- در سلول الکترولیتی هر دو الکترود در یک ظرف نگهداری می شود و نیازی به پل نمکی نیست.
محدودیت های پل نمکی
محدودیت هایی برای استفاده از پلهای نمکی وجود دارد:
- سرعتی پخش یون ها از طریق پل نمکی می تواند سرعت جریان الکترون ها را محدود کند و در نتیجه جریان کمی ایجاد می شود.
پل نمک طوری ساخته می شود که یون ها فقط از طریق انتشار به داخل و خارج آن وارد شوند. در نتیجه، سرعتی که یونها میتوانند از طریق پل نمکی پخش شوند، سرعت جریان الکترونها در مدار خارجی را محدود میکند.
از آنجایی که انتشار یک فرآیند آهسته است، سلول تنها می تواند جریان کمی را عبور دهد. از دیدگاه الکتریکی، انتشار آهسته یونها از طریق پل نمکی باعث میشود که گونههای دارای بار مثبت در یک انتهای پل نمکی و گونههای دارای بار منفی در سر دیگر ایجاد شوند. این عدم تعادل بار به این معنی است که یک گرادیان بالقوه در سراسر پل نمک وجود دارد که اثر آن مخالفت با جریان بیشتر است.
دیگر محدودیت ها:
۱. خشک شدن محلول الکترولیت: در صورتی که محلول الکترولیت در پل نمکی خشک شود، میتواند به موجب قطع جریان الکتریکی شود یا عملکرد دستگاه را تحت تاثیر قرار دهد.
۲. بهروز نبودن پل نمکی: استفاده از یک پل نمکی قدیمی و ناکارآمد میتواند باعث عدم حفظ تعادل بار در دو نیمسلول و از بین رفتن عملکرد دستگاه شود.
۳. نفوذ یونها از پل نمکی: در برخی موارد، یونها ممکن است به طور غیرمنظم از پل نمکی نفوذ کرده و باعث تغییر در غلظت الکترولیتها شوند که این میتواند به اختلال در عملکرد سلول الکتروشیمیایی منجر شود.
۴. نیاز به نگهداری و تعویض منظم: پل نمکیها نیازمند نگهداری و تعویض منظم هستند تا عملکرد صحیح دستگاه را تضمین کنند.
جایگزین های پل های نمکی
چندین جایگزین برای پل های نمکی سنتی را می توان در سلول های الکتروشیمیایی استفاده کرد.
- یک جایگزین نمک مذاب آبگریز در دمای اتاق (مایع یونی) است که نشان داده شده است جایگزین امیدوارکننده ای برای پل های نمک سنتی است.
- جایگزین دیگر استفاده از موادی مانند کاغذ صافی، پنبه، لوله های نیمه میکرو و ویال ها برای ساختن پل های نمک در محیط های آزمایشگاهی آموزشی است.
با این حال، این جایگزین ها ممکن است به اندازه پل های نمک سنتی مبتنی بر کلرید پتاسیم، که بیش از 100 سال است مورد استفاده قرار می گیرند و در این زمینه ضروری تلقی می شوند، موثر نباشند.
تفاوت پل نمکی و دیسک متخلخل:
از دیسک های متخلخل زمانی استفاده می شود که الکترودها در یک محلول قرار دارند، در حالی که پل های نمکی زمانی استفاده می شوند که الکترودها و محلول های آنها در دو ظرف مختلف قرار دارند.
پل نمکی از تجمع بارهای مثبت یا منفی در الکترودها جلوگیری می کند و محلول را خنثی نگه داشته و از اختلال در واکنش الکتروشیمیایی جلوگیری می کند تا جریان الکتریکی بتواند به تولید ادامه دهد.
:Refrence

