سری الکتروشیمیایی عناصر
این مقاله در مورد سری الکتروشیمیایی عناصر در شیمی است.
در این مقاله یاد خواهید گرفت که سری الکتروشیمیایی چیست،اما قبل از آن اطلاعاتی مقدماتی در مورد نیم سلول ها، سلول های الکتروشیمیایی و پتانسیل الکترود استاندارد کسب می کنید.
سپس سری الکتروشیمیایی را در قالب یک جدول خواهید دید.در نهایت، کاربردهای سری الکتروشیمیایی را بررسی خواهیم کرد.
مقدمه سری الکتروشیمیایی
برخی از عناصر نسبت به عناصر دیگر الکترون های خود را راحت تر از دست می دهند. این یک اصل اساسی در شیمی و اساس واکنش های ردوکس است.
برای بررسی جزئیات بیشتر، باید سری الکتروشیمیایی را بررسی کنیم. اما قبل از آن اطلاعاتی مقدماتی درخصوص آشنایی با نیمسلولها، سلولهای الکتروشیمیایی، و پتانسیل الکترود استاندارد کسب می کنیم.
نیمه واکنش ها در سری الکتروشیمیایی فلزات
یونها یا مولکولها به سطح الکترود منتقل شده و پس از آن بسته به پتانسیل اعمال شده به الکترود ، اکسایش یا کاهش می یابد.
- اگر پتانسیل مثبت کافی به الکترود اعمال شود، مولکول ها (یا یون ها) تمایل به اکسید شدن دارند
- برعکس، اگر پتانسیل منفی به اندازه کافی به الکترود اعمال شود، مولکول ها (یا یون ها) تمایل به کاهش دارند.
کاهش در یک الکترود به این معنی است که الکترون ها به یون یا مولکول اضافه می شوند. جریانی که در این جهت حرکت می کند جریان کاتدی است. شکل کلی نیمه واکنش کاهشی که در یک الکترود رخ می دهد ممکن است به صورت زیر نوشته شود:
O+ne –>R
که در آن n تعداد کل الکترونهایی است که وقتی که گونه از حالت اکسید شده (O) به شکل احیا شده (R) تبدیل میشود به مولکول (یا یون) اضافه میگردد.
اکسایش در یک الکترود به این معنی است که الکترونها از یک یون یا مولکول حذف شده، از محلول خارج میشوند و به داخل الکترود میروند. جریانی که در این جهت حرکت می کند، جریان آندی است و اکسیداسیونی که در الکترود اتفاق می افتد را می توان با نیمه واکنش ردوکس زیر نشان داد:
R –> O+ne
با توجه به اینکه نیمه واکنش های الکتروشیمیایی می توانند در هر دو جهت رخ دهند، اغلب با استفاده از نماد تعادل شیمیایی به صورت زیر نوشته می شوند:
O+ne –> R
عوامل کاهنده و اکسنده در جدول الکتروشیمیایی
یک عامل کاهنده گونه دیگری را کاهش می دهد. این به این معنی است که به آن الکترون می دهد.
- منیزیم به ازدست دادن الکترون ها برای تشکیل یون تمایل دارد. لذا منیزیم یک عامل کاهنده خوب است.
یک عامل اکسید کننده گونه دیگری را اکسید می کند. این به این معنی است که از آن گونه الکترون می گیرد.
- مس به راحتی یون های خود را تشکیل نمی دهد و یون های آن به آسانی الکترون ها را از منبع دیگری دریافت می کنند تا به مس فلزی برگردند. یون های مس (II) باید عامل اکسید کننده خوبی باشند.
مثالی از نیم سلول الکتروشیمیایی
هنگامی که یک میله از جنس روی در یک محلول حاوی یونهای روی قرار گیرد، یک تعادل برقرار میشود:
در این تعادل، برخی از اتمهای روی الکترونهای خود را از دست داده و یونهای روی را تشکیل میدهند.
معادله زیر این فرایند را نشان میدهد:
(این نوشتار مشتمل بر نمایش یونها و الکترونها در سمت چپ و اتم فلز در سمت راست است.)
![]()
یونهای روی به داخل محلول حرکت کرده و الکترونهای آزاد شده روی میله جمع میشوند و به میله بار منفی میدهند.
این وضعیت اختلاف پتانسیلی بین میله روی و محلول یون روی ایجاد میکندکه به عنوان پتانسیل الکترود شناخته میشود.اختلاف پتانسیل دقیق سیستم به واکنش پذیری و قدرت آزادسازی الکترونها توسط روی بستگی دارد.
- هرچه اختلاف پتانسیل منفیتر باشد، تعادل در سمت چپ بیشتر است و فلز راحتتر الکترونهای خود را از دست می دهد. به عنوان مثال، فلزی که اختلاف پتانسیل 1.2- ولت ایجاد می کند، راحت تر از فلزی که اختلاف پتانسیل 0.3- را ایجاد می کند، الکترون های خود را رها می کند و کاهنده تر است.
حال اگر میله ای از مس را در محلولی از یون های مس قرار دهید چه اتفاقی می افتد؟
برخی از اتمهای مس واکنش داده، الکترونهای خود را رها کرده و یونهای مس را تشکیل میدهند. و در نهایت یک تعادل ایجاد خواهد شد. اما مس کمتر از روی واکنشپذیر است و در رها کردن الکترونهای خود چندان خوب نیست .
میتوان گفت که مس عامل احیاکننده بدتری است .یعنی اختلاف پتانسیل سیستم مسی از اختلاف پتانسیل سیستم روی، کمتر منفی است.
-
سیستمی که با قرار دادن یک فلز در محلولی از یون های خودش ایجاد می شود را نیم سلول می نامیم .
-
عوامل کاهنده خود اکسیده می شوند. این بدان معنی است که یک عامل کاهنده بهتر، راحت تر اکسید می شود .
سلول گالوانی روی مس
اگر نیم سلول روی و نیم سلول مسی را با سیم و پل نمکی به هم وصل کنید چه اتفاقی می افتد؟
روی عامل کاهنده بهتری از مس است (واکنش پذیرتر است و الکترون های خود را راحت تر از دست می دهد.) این بدان معنی است که اختلاف پتانسیل منفی تری نسبت به مس دارد . این موضوع اختلاف پتانسیلی کلی بین دو سلول ایجاد میکند، که میتوانیم آن را پتانسیل الکترود نیز بنامیم ، و نشان میدهد که این دو فلز با چه سرعتی الکترونهای خود را از دست می دهند. اختلاف پتانسیل توسط یک ولت متر متصل به سیستم اندازه گیری می شود.
ترکیب دو نیم سلول به عنوان یک سلول الکتروشیمیایی شناخته می شود.
- از آنجایی که روی اختلاف پتانسیل منفی بیشتری نسبت به مس دارد، تجمع الکترون های بیشتری روی میله روی وجود دارد.
- اگر اجازه دهیم این الکترون ها جریان داشته باشند، آنگاه آنها از روی سیم که عامل کاهنده بهتر است به مس می روند که عامل کاهنده بدتری است.
- در همین حال، یونهای مثبت محلول از طریق پل نمک در همان جهت جریان مییابند تا بار را متعادل کنند.
- اتم های روی به یون روی تبدیل می شوند و الکترون ها را از دست می دهند. یون های مس به اتم های مس تبدیل می شوند و الکترون به دست می آورند.
در اینجا دو معادله وجود دارد:

به طور کلی، الکترون ها همیشه از عامل احیا کننده بهتر (فلز واکنش پذیرتر، که الکترون های خود را راحت تر می دهد) به عامل احیا کننده بدتر (فلز کمتر واکنش پذیر، که در رها کردن الکترون های خود بدتر است) حرکت می کنند.
(جهت مطالعه الکتروشیمی و پیل الکتروشیمیایی کلیک کنید)
جدول پتانسیل الکتروشیمیایی
پتانسیل الکترود استاندارد
می دانیم که اگر یک فلز در محلول قرار گیرد، تعادلی از اتم های فلز و یون های فلزی ایجاد می شود و اختلاف پتانسیلی ایجاد می کند که مقدار آن به موقعیت تعادل بستگی دارد.
ما نمی توانیم به طور مستقیم تفاوت پتانسیل تولید شده توسط یک نیم سلول را اندازه گیری کنیم. با این حال، ما می توانیم اختلاف پتانسیل ایجاد شده را هنگام اتصال دو نیم سلول به یکدیگر در یک سلول الکتروشیمیایی اندازه گیری کنیم.
اگر اختلافهای پتانسیلی که در اثر اتصال یک مجموعه گسترده از نیمسلولهای مختلف به یک نیمسلول مرجع خاص ثبت شود، میتوانیم یک جدول ایجاد کنیم که این ارقام را مقایسه کرده و بنابراین فلزها را از فعّالترین (بهترین عامل کاهنده) تا کمفعّالترین (بدترین عامل کاهنده) رتبهبندی کنیم.
در واقع دانشمندان این کار را انجام داده اند. نیم سلول مرجع مورد استفاده الکترود هیدروژن است . ما اختلاف پتانسیل بین نیم سلول و الکترود هیدروژن مرجع را در شرایط استاندارد پتانسیل الکترود استاندارد سلول می نامیم .این کار اندازهگیری قابلیت کاهندگی عناصر است.
پتانسیل استاندارد الکترود،°E، اختلاف پتانسیلی است که هنگام اتصال یک نیم سلول به یک نیم سلول هیدروژنی در شرایط استاندارد ایجاد می شود. همچنین به عنوان نیروی الکتروموتوری یا پتانسیل کاهش استاندارد نیز شناخته می شود.
شرایط استاندارد عبارتند از:
are: 298 K, 1.00 mol dm-3 and 100 kPa.
نشان دادن پتانسیل استاندارد الکترود
ما پتانسیل های استاندارد الکترود (°E) را با استفاده از نیمه معادلات، شامل عنصر و یون ها نشان می دهیم. به موارد زیر توجه کنید:
- واکنش گونه ها بهعنوان پتانسیل کاهش نوشته میشود. یعنی یون ها و الکترون ها را در سمت چپ و عنصر ترکیب شده را در سمت راست می نویسیم.
- هیدروژن همیشه مقدار صفر دارد، زیرا استانداردی است که با آن همه پتانسیل های الکترود دیگر را اندازه گیری می کنیم.
- پتانسیل الکترود منفی تر به این معنی است که عنصر با احتمال بیشتری الکترون های خود را رها می کند و ماده کاهنده بهتری است و به راحتی اکسید می شود.
- پتانسیل الکترود مثبت تر به این معنی است که احتمال کمتری وجود دارد که عنصر الکترون های خود را رها کند. این یک عامل اکسنده بهتر است و به راحتی کاهیده می شود.
در اینجا پتانسیل الکترود استاندارد برای روی :
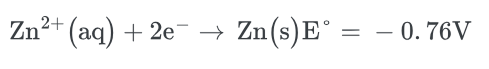
مقدار پتانسیل استاندارد الکترود منفی است. این بدان معنی است که روی کاهنده بهتری از هیدروژن است و به راحتی اکسید می شود.
محاسبه پتانسیل واکنش در شرایط غیر استاندارد
برای در نظر گرفتن امکان فعالیتهای غیر واحدی، میتوان از معادله نرنست (جهت مطالعات بیشتر در این زمینه کلیک کنید) برای بیان پتانسیل الکترود تعادل (ENERNSTIAN) بر حسب فعالیتهای واقعی استفاده کرد.
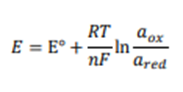
که در آن پارامترها به شرح زیر است:
- T دما (K)،
- F ثابت فارادی (F = 96485 C / mol)
- R ثابت گاز ایده آل (R = 8.3145 J /mol K).
معمولاً فعالیت مولکول ها یا یون های محلول در محلول با غلظت مولی آنها یکسان فرض می شود، بنابراین معادله نرنست اغلب به صورت زیر نوشته می شود:
![[E=E0+RT/nF ln [ox]/[red](https://www.behpajooh.net/wp-content/uploads/2023/12/y2.png)
که در آن COx و CRed غلظت مولکول ها یا یون های محلول در شکل های اکسید شده و احیا شده به ترتیب در سطح الکترود هستند. توجه داشته باشید که هر ماده در فاز مایع یا جامد در سطح الکترود (مانند حلال یا خود الکترود) دارای فعالیت واحد است و در معادله نرنست ظاهر نمی شود.
این نیمه واکنش در یک الکترود را می توان با اعمال پتانسیل به الکترود (EAPPLIED) که منفی تر از پتانسیل الکترود تعادل است (EAPPLIED < ENERNSTIAN) در جهت کاتدی (کاهشی) هدایت کرد. نیمه واکنش را می توان با اعمال پتانسیل مثبت تر از پتانسیل الکترود تعادل در جهت اکسید کننده (آندی) هدایت کرد (EAPPLIED > ENERNSTIAN).
سری الکتروشیمیایی چیست
جمع آوری پتانسیل الکترود استاندارد عناصر مختلف باعث ایجاد سری الکتروشیمیایی می شود.
سری الکتروشیمیایی لیستی از پتانسیل الکترود استاندارد عناصر به ترتیب است که به ما می گوید هر عنصر در مقایسه با یک نیمه سلول مرجع الکترود هیدروژن، چقدر راحت اکسید می شود.
سری الکتروشیمیایی اساس همه سلول های سوختی و باتری ها است اما قبل از اینکه به این کاربردها بپردازیم، اجازه دهید نگاهی به خود سری الکتروشیمیایی در قالب یک جدول بیندازیم.
جدول سری الکتروشیمیایی
این سری الکتروشیمیایی است. ما آن را به عنوان جدولی از نیم سلول های مختلف و پتانسیل های الکترودی استاندارد آنها نشان داده ایم.
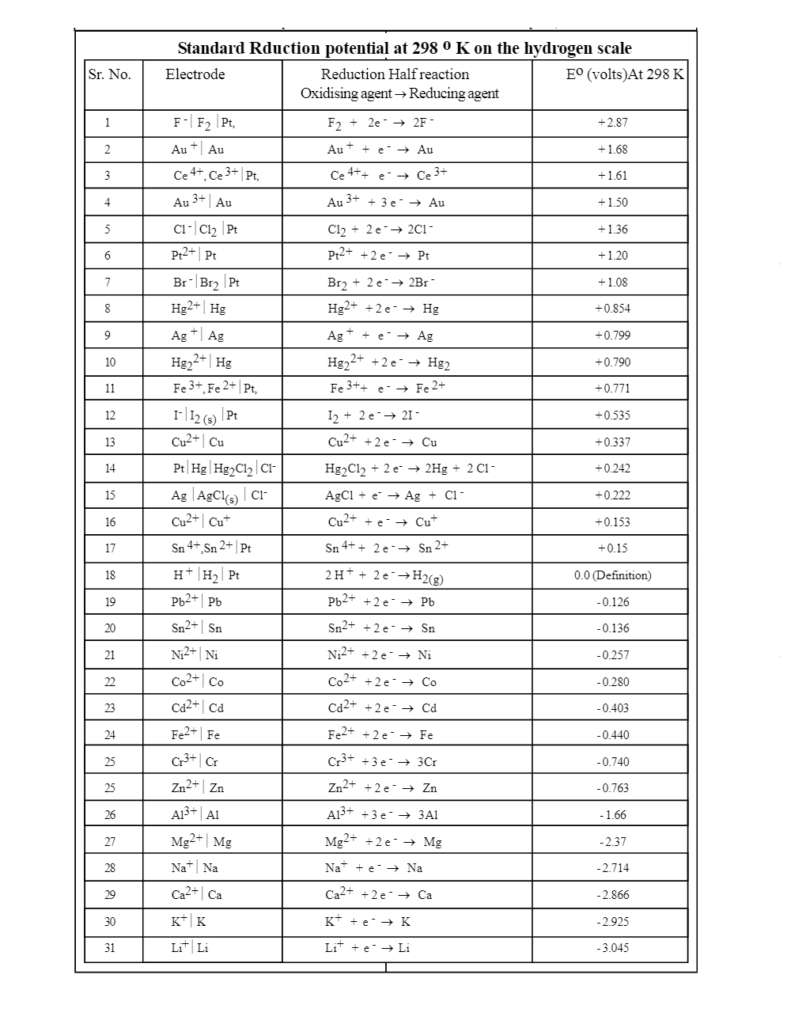
توجه داشته باشید که سری الکتروشیمیایی می تواند از مثبت به منفی یا منفی به مثبت نوشته شود. در اینجا، ما آن را از مثبت به منفی، با عنصری که به راحتی کاهیده میشود (-F) در بالا و عنصری که به راحتی اکسید می شود (لیتیوم،) در پایین نشان داده ایم. این بدان معنی است که لیتیوم قوی ترین عامل کاهنده است.
کاربردهای جدول الکتروشیمیایی عناصر
ما یاد گرفتیم که سری الکتروشیمیایی چیست. حال اجازه دهید برخی از کاربردهای آن را در نظر بگیریم .
- ترکیب دو نیم سلول با پتانسیل های الکترودی متفاوت یک سلول الکتروشیمیایی ایجاد می کند . ما می توانیم از این سلول برای تولید برق استفاده کنیم. به همین دلیل، سری الکتروشیمیایی اساس پیل های سوختی و باتری ها است .
- ما همچنین می توانیم از پتانسیل الکترود برای محاسبه پتانسیل کلی سلول الکتروشیمیایی استفاده کنیم.
- علاوه بر این، سری الکتروشیمیایی به ما اجازه می دهد تا جهت یک واکنش ردوکس را پیش بینی کنیم و پیش بینی کنیم که آیا واکنش های نا متناسب ممکن است رخ دهد یا خیر. به طور کلی، الکترون ها از گونه ای با پتانسیل الکترود استاندارد منفی تر به گونه ای با پتانسیل الکترود استاندارد مثبت تر حرکت می کنند.
- همچنین می توانیم از آن برای شناسایی عوامل اکسید کننده و کاهنده قوی و ضعیف استفاده کنیم. به طور کلی، گونه هایی با پتانسیل الکترود منفی، عوامل کاهنده خوبی هستند و تمایل به از دست دادن الکترون خود دارند.
نکات کلیدی سری الکتروشیمیایی
- سری الکتروشیمیایی لیستی از عناصر است که بر اساس پتانسیل الکترودی استاندارد آنها مرتب شده اند . به ما می گوید که هر عنصر در مقایسه با یک نیمه سلول مرجع ، الکترود هیدروژن ، چقدر راحت اکسید می شود .
- پتانسیل الکترود منفی به این معنی است که یک عنصر راحت تر از هیدروژن اکسید می شود، در حالی که پتانسیل الکترود مثبت به این معنی است که یک عنصر به راحتی کمتر از هیدروژن اکسید می شود.
- پتانسیل الکترود استاندارد تحت شرایط استاندارد K 298 , 1.00 mol dm -3 و 100 kPa اندازه گیری می شود .
- سری الکتروشیمیایی را می توان برای ایجاد سلول های الکتروشیمیایی ، پیش بینی جهت واکنش های ردوکس و شناسایی عوامل اکسید کننده و کاهنده قوی و ضعیف استفاده کرد .
سوالات متداول در مورد سری های الکتروشیمیایی
- سری الکتروشیمیایی چیست
پاسخ: سری الکتروشیمیایی لیستی از عناصری است که بر اساس پتانسیل الکترودی استاندارد آنها مرتب شده اند.
- سری الکتروشیمیایی چه اهمیتی دارد؟
پاسخ: اطلاعات مهمی در مورد اینکه کدام مواد عامل اکسید کننده خوب و کدام یک عامل کاهنده خوب هستند به ما می دهد و همچنین به ما کمک می کند جهت واکنش های ردوکس را پیش بینی کنیم.
- ترتیب سری الکتروشیمیایی چگونه است؟
پاسخ: در یک سری الکتروشیمیایی، گونه ها به ترتیب پتانسیل الکترودی استانداردشان مرتب می شوند. سری الکتروشیمیایی می تواند از مثبت به منفی یا منفی به مثبت اجرا شود. عموما منفی ترین مقدار E° در بالای سری الکتروشیمیایی و بیشترین مقدار مثبت در پایین قرار می گیرد.
- برخی از کاربردهای سری الکتروشیمیایی چیست؟
پاسخ: سری الکتروشیمیایی را می توان برای شناسایی عوامل اکسید کننده و کاهنده خوب، محاسبه پتانسیل سلولی سلول های الکتروشیمیایی و پیش بینی جهت واکنش های ردوکس استفاده کرد.
- نمونه ای از سری الکتروشیمیایی چیست؟
پاسخ: روی و مس را در نظر بگیرید. روی در رها کردن الکترونهای خود بهتر از مس است و بنابراین پتانسیل الکترود منفیتری دارد: پتانسیل الکترود استاندارد آن در مقایسه با مس 0.34+ ولت است. بنابراین در یک سری الکتروشیمیایی که از منفی به مثبت میروند، روی بالاتر است. در سری نسبت به مس.
- تفاوت بین سری الکتروشیمیایی و سری واکنش چیست؟
پاسخ: اساساً ECS (سری الکتروشیمیایی) باید به حالت آبی اشاره داشته باشدبه عنوان مثال، در طول الکترولیز، مواد شیمیایی در حالت آبی هستند (در آب حل می شوند و یون تشکیل می دهند). از طرف دیگر، یک سری واکنش به واکنشی اطلاق می شود که در حالت آبی نیست.
رفرنس:
https://www.studysmarter.co.uk/explanations/chemistry/physical-chemistry/electrochemical-series/


1 نظر
به گفتگو بپوندید و نظر خود را به ما بگویید.
متشکرم