الکتروشیمی، سلول گالوانی و سلول الکترولیتی
- تعریف الکتروشیمی.
- واکنش های الکتروشیمیایی.
- اجزای اصلی سلول های الکتروشیمیایی .
- برخی از ویژگی ها و کاربردهای الکتروشیمی
- پیل چیست؟اجزای پیل الکتروشیمیایی، نحوه اتصال نیم پیل ها.
- انواع پیل های الکتروشیمیایی: سلول گالوانی یا پیل ولتایی، سلول الکترولیتی، پیل الکتروشیمیایی برگشت پذیر، پیل الکتروشیمیایی برگشت ناپذیر
- نیروی الکتروموتوری پیل ها(e.m.f): emf چیست؟پيل دانيل چیست؟ الکترود استاندارد هیدروژن (S.H.E) چیست؟
- دستگاه های الکتروشیمی
الکتروشیمی چیست
الکتروشیمی مطالعه الکتریسیته و چگونگی ارتباط آن با واکنش های شیمیایی است.
واکنش الکتروشیمیایی
چنین واکنش هایی به طور کلی به دو دسته طبقه بندی می شوند:
- انجام شدن واکنش های شیمیایی غیرخودبه خودی باکمک انرژی الکتریکی (الکترولیز).
- تولید انرژی الکتریکی با کمک واکنش شیمیایی اکسایش – کاهش خودبه خودی.
در اصل الکتروشیمی به واکنش یک گونه شیمیایی در سطح مشترک بین یک هادی الکترون و یک هادی یونی مربوط می شود که در آن انتقال بار بین گونه های شیمیایی و الکترود وجود دارد.
انتقال بار می تواند به طور همگن در محلول بین گونه های شیمیایی مختلف یا به طور ناهمگن روی سطوح الکترود رخ دهد.
مبادله الکترون بین دو گونه شیمیایی به شرح زیر است:
- مستقیم(همگن): گونه کاهنده و اکسنده در تماس مستقیم با یکدیگر الکترون مبادله میکنند.
- غیرمستقیم(نا همگن): انتقال الکترون بین دوگونه از طریق الکترود ها و مدار خارجی صورت میگیرد .
به منظور اطمینان از الکتروخنثی بودن در دو یا چند نیمه واکنش، انتقال بار به طور همزمان در جهت مخالف انجام می شود:
اکسیداسیون، از دست دادن الکترون ها یا افزایش حالت اکسیداسیون و کاهش به دست آوردن الکترون ها یا کاهش در حالت اکسیداسیون است.
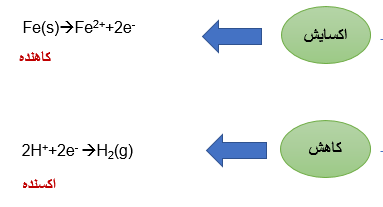
سلول الکتروشیمیایی
سلول الکتروشیمیایی هر وسیله ای است که در آن انرژی شیمیایی به انرژی الکتریکی یا انرژی الکتریکی به انرژی شیمیایی تبدیل می شود.
:سه جزء اصلی سلول های الکترولیتی عبارتند از
- کاتد
- آند
- الکترولیت
- برای انتقال الکترون ها باید هادی وجود داشته باشد. این هادی معمولا نوعی سیم است تا الکترون ها بتوانند از یک مکان به مکان دیگر حرکت کنند.
- یون ها همچنین باید بتوانند از طریق نوعی پل نمکی که مهاجرت یون ها را تسهیل می کند، حرکت کنند. هادی یونی که الکترولیت نامیده می شود، می تواند بر پایه محلول (یون های محلول در حلال های آبی یا آلی) یا در حالت جامد باشد.
- الکترود به طور کلی از یک ماده فلزی یا نیمه هادی تشکیل شده است .
الکترودها با مسیرهای رسانا هم در محلول (از طریق انتقال یونی) و هم به صورت خارجی (از طریق سیمهای الکتریکی و غیره) به هم متصل میشوند تا بار منتقل شود و مدار الکتریکی تکمیل گردد.
پیل چیست
پیل جایگاه انجام واکنش الکتروشیمیایی است .
اجزای پیل الکتروشیمیایی
هر پیل از دو نیم پیل آندی و کاتدی تشکیل میشود.
- کاتولیت: محلول الکترولیت حاوی نیم پیل کاتدی
- آنولیت: محلول الکترولیت حاوی نیم پیل آندی.
نحوه اتصال نیم پیل ها:
- آنولیت و کاتولیت یکسان:دو الکترولیت درون محلول واحد هستند و گونه ها به طور مستقیم واکنش میدهند بنابراین جریان عبوری از مدار خارجی نا چیزاست .
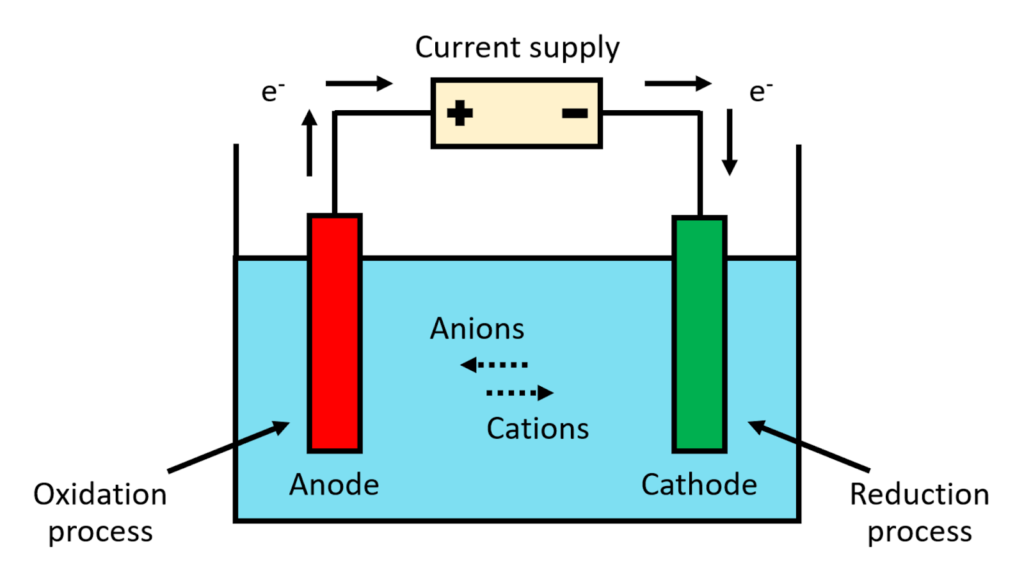
- آنولیت و کاتولیت متفاوت با یکدیگر واکنش نمیدهند: آنولیت و کاتولیت توسط یک غشا از یکدیگر جدا شده و از اختلاط سریع و آزادانه دو الکترولیت جلوگیری میشود.
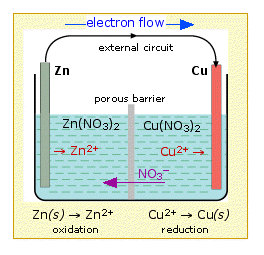
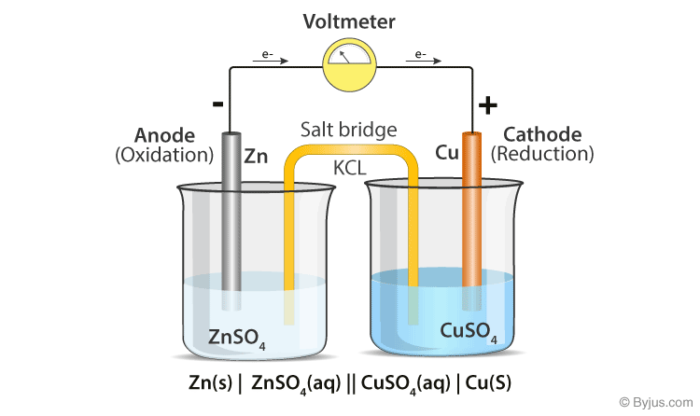
- آنولیت و کاتولیتِ متفاوت، با یکدیگر واکنش میدهند: از پل نمکی استفاده میشود. پل نمکی الکترولیتی قوی با غلظت بالا است که با آنولیت و کاتولیت واکنش نمیدهد و به انتقال الکترون و یون می پردازد.
انواع پیل های الکتروشیمیایی
-
a. از دیدگاه تولید و مصرف الکتریسیته
-
b. از دیدگاه نوع و ماهیت واکنش درحال انجام
سلول گالوانی یا پیل ولتایی
در سلول گالوانی واکنش به صورت خود به خودی انجام میگیرد.
آند و کاتد در سلول گالوانی
آند: الکترودی که گونه در آن اکسید میگردد و تولید الکترون میکند—> چشمه الکترون است و علامت آن (-)
کاتد: گونه قرار گرفته در آن برای احیا شدن نیاز به الکترون دارد—-> کمبود الکترون دارد و علامت آن (+)
سلول الکترولیتی
در سلول الکترولیتی واکنش به صورت خود به خودی نیست و نیازمند اعمال اختلاف پتانسیلی مناسب با استفاده از یک منبع خارجی است.
آند و کاتد در سلول الکترولیتی
این پیل ها عکس پیل گالوانی می باشند :آند قطب (+) و کاتد قطب (–) است .
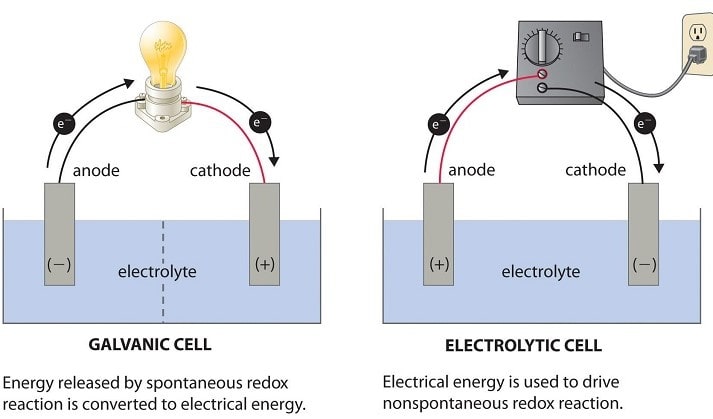
تفاوت سلول گالوانی و الکترولیتی
تفاوت این دو سلول در خودبه خودی بودن یا نبودن واکنش و قطبیت الکترودها است.
|
سلول ولتایی / سلول گالوانی |
سلول الکترولیتی |
| این سلول انرژی شیمیایی را به انرژی الکتریکی تبدیل می کنند. | در این سلولانرژی الکتریکی به انرژی شیمیایی تبدیل می شود. |
| این سلول ها تحت واکنش های ردوکس کاملاً خود به خودی قرار می گیرند. | واکنشهای ردوکس در این سلولها خود به خودی نیستند. در عوض برای رخ دادن آنها وجود انرژی اولیه ضروری است. |
| منبع الکترون ها گونه ای است که اکسید می شود. | الکترون ها از یک منبع بیرونی (مانند باتری) می آیند. |
- b. از دیدگاه نوع و ماهیت واکنش درحال انجام:
پیل الکتروشیمیایی برگشت پذیر
با تغیر جهت جریان در آن تنها جهت واکنش های الکترودی عوض میشود وماهیت آن ها ثابت باقی می ماند.
این پیل ها قابلیت شارژ مجدد دارند(باطری ماشین) یعنی پس از مدتی کار کردن در حالت گالوانیک و خالی شدن (دشارژ)، می توان آن را با اعمال پتانسیل مناسب از بیرون به صورت الکترولیزی به کار انداخت و پر(شارژ)کرد.
پیل های گالوانیک برگشت پذیرنیز پس از بارها تخلیه و پر شدن، برگشت پذیری خود را از دست می دهند.

جهت مطالعه در مورد سلول گالوانی روی مس کلیک کنید.
پیل الکتروشیمیایی برگشت ناپذیر
با تغییر در جهت جریان علاوه بر تغیر در جهت واکنش های الکترودی ماهیت و نوع واکنش نیز تغییر میکند. این پیل ها قابلیت شارژ مجدد ندارند.

نیروی الکتروموتوری پیل ها (e.m.f):
emf چیست
EMF مخفف رایج نیروی الکتروموتوری است.
نیروی محرکه الکتریکی به عنوان پتانسیل الکتریکی تولید شده توسط یک سلول الکتروشیمیایی یا با تغییر میدان مغناطیسی تعریف می شود.
پتانسیل نسبی الکترودها:
پتانسیل یک الکترود یا نیم پیل را می توان ناشی از نیروی محرکه شیمیایی نیم واکنشی در نظر گرفت که در لایه نازکی در سطح تماس الکترود و محلول الکترولیت (لایه انتشار) به وقوع پیوسته و به تعادل می رسد.
اندازه گیری پتانسیل یک الکترود به طور مطلق میسر نبوده و همواره باید آن را نسبت به یک نیم پیل دیگر سنجید که به این پتانسیل پتانسیل نسبی می گویند.
الکترود مرجع یا شاهد
دارای پتانسیل ثابت و مشخصی است و پتانسیل نیم پیل ما نسبت به آن سنجیده میشود.
الکترود شناساگر
الکترودی که در نیم پیل مورد نظر ما قرار دارد و می خواهیم پتانسیل آن را نسبت به مرجع بسنجیم .
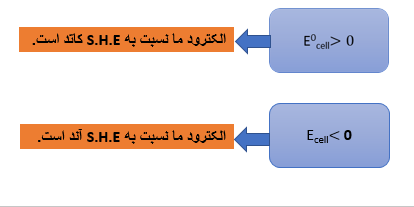
تعین پتانسیل استاندارد E0 احیا گونه ها:
پتانسیل نیم پیل نسبت به الکترود استاندارد هیدروژن (S.H.E) سنجیده میشود.این نیم پیل شامل الکترودی از گونه و محلول الکترولیت نمک گونه با فعالیت واحد می باشد.
الکترود استاندارد هیدروژن (S.H.E)
این الکترود متشکل است از یک صفحه پلاتین که در محلولی از HCl با aH+=1M قرار دارد و گاز هیدروژن با فشار 1 اتمسفر در آن دمیده میشود،به طوری که سطح الکترود پیوسته با یون های+H و H2 در حال تعادل است.
این سیستم از نظر سینتیکی برگشت پذیر است و E0 سلول به طور قردادی صفر در نظر گرفته میشود.
E0cell= E0c-E0a
نیروی الکتروموتوری پیل به صورت اختلاف پتانسیل بین آند و کاتد تعریف میگردد:
(جهت مطالعه بیشتر در این خصوص به مطلب سری الکتروشیمیایی عناصر مراجعه کنید.)
پيل دانيل چیست
- اين پيل شامل الكترود مس فرو برده شده در محلول يون هاي مس (II) والكترود روي فرو برده شده در محلول يون هاي روي (II) است.
پيل دانيل
- ارتباط الكتريكي بين دو محلول با يك لوله U شكل وارونه كه داراي محلول پتاسيم كلريد است و پل نمكي ناميده ميشود برقرار مي شود.
- ارتباط الكتريكي بين دو الكترود نيز با استفاده از سيم فلزي برقرار مي شود.
- اختلاف پتانسيل بين دو الكترود توسط يك ولت سنج با مقاومت دروني زياد و يا قرار دادن وسيله مناسب ديگري در مدار اندازه گيري مي شود.
کاربرد الکتروشیمی
الکتروشیمی کاربردهای رایج بسیاری در زندگی روزمره دارد. همه انواع باتری ها (یکی از کاربردهای سلول الکترولیتی)، از باتری هایی که برای روشن کردن چراغ قوه استفاده می شوند تا ماشین حساب و خودرو، برای تولید برق به واکنش های شیمیایی متکی هستند.از الکتریسیته برای آبکاری کردن اجسام با فلزات تزئینی مانند طلا یا کروم استفاده می شود. الکتروشیمی در انتقال تکانه های عصبی در سیستم های بیولوژیکی مهم است.
الکتروشیمی مدرن نیز برای رفع تعدادی از مشکلات شیمیایی فعلی به کار می رود:
-
میکروالکترودهای بسیار کوچک، برای بررسی رویدادهای بیوشیمیایی در سطح سلولی استفاده میشوند.
-
فرآیندهای خوردگی صنعتی با استفاده از الکترودهای دیسک دوار نظارت می شوند.
-
روشهای ولتامتری با حد تشخیص پایین به طور شگفت انگیز، برای نظارت بر سطح سرب در جریان خون استفاده میشوند.
-
الکترودهای پوشش داده شده با پلیمرهای خاص به عنوان آشکارسازهای گلوکز برای بیماران دیابتی استفاده می شوند.
-
استفاده از آشکارسازی الکتروشیمیایی همچنین در حال گسترش دامنه آنالیزهایی است که می توان با استفاده از کروماتوگرافی مایع انجام داد.
دستگاه الکتروشیمی
تجهیزات مورد نیاز برای واکنش های الکتروشیمیایی کاملاً ارزان است (یک موسسه اکنون می تواند یک سیستم پتانسیواستات کاملاً کاربردی را با هزینه کمتر از هزینه یک اسپکتروفتومتر مرئی یا یک کروماتوگرافی گازی خریداری کند.)
شرکت ما هر آنچه را که برای شروع آموزش ولتامتری مدرن در آزمایشگاه در مقطع کارشناسی لازم است را ارائه می دهد. (صفحه خرید و مسخصات دستگاه آنالایزر الکتروشیمی BHP-2066).
جهت مطالعه وسایل لازم برای آزمایشگاه الکتروشیمی کلیک کنید.


