ولتامتری چرخه ای: تعین غلظت آهن مجهول
آزمایش مقدمه ای بر ولتامتری چرخه ای :
- هدف این آزمایش یافتن غلظت آهن در یک محلول آزمایشی ناشناخته با کمک تکنیک ولتامتری چرخه ای می باشد و مقدمه خوبی برای آشنایی با ولتامتری چرخه ای و کار با سلول های الکتروشیمیایی، پتانسیواستات ها و معادله Randles-Sevcik است.
تعین غلظت آهن مجهول با ولتامتری چرخه ای
هدف آزمایش ولتامتری چرخه ای
در این آزمایش موارد زیر آموزش داده میشود :
-
آشنایی با یک پتانسیواستات الکتروشیمیایی مدرن،
-
تعیین غلظت آهن (III) در محلول ناشناخته،
-
اندازه گیری ضریب انتشار برای آهن (III).
این روش نشان میدهد که چگونه جریان مشاهدهشده در آزمایش ولتامتری چرخهای به پارامترهای تجربی مانند غلظت و نرخ روبش بستگی دارد.
دستگاه های ولتامتری چرخه ای
- آنالایزر الکتروشیمیایی BHP 2066
- بسته نرم افزاری BHP 2066
- سلول سه الکترود (تهیه هوادهی نیتروژن اختیاری است.)
- الکترود دیسک پلاتین
- الکترود کمکی پلاتین
- الکترود مرجع SCE
- محلول پولیش آلومینا
- پنج عدد فلاسک حجمی 100 میلی لیتری
- پیپت (2، 5، 10، 20 و 25 میلی لیتر)
معرف ها و مواد شیمیایی
|
در هر 20 آزمایش*
|
به ازای هر آزمایش |
شرح |
|
15 لیتر
|
600 میلی لیتر | 1.0 مولار اسید کلریدریک |
| 2 لیتر |
75 میلی لیتر
|
250 میلی مولار کلرید آهن (III) در 1.0 مولار HCl (40.5 گرم FeCl3 در هر لیتر محلول اسید)
|
*شامل مقادیر مورد نیاز مربی برای تهیه موجودی و راه حل های ناشناخته برای کل گروه است.

ولتامتری چرخه ای چیست
ولتامتری چرخه ای شاید رایج ترین روش الکتروتحلیلی مورد استفاده باشد. یک ولتاموگرام چرخه ای(یا CV) نموداریست که از تکنیک ولتامتری چرخه ای به دست می آید. در این روش یک روبش پتانسیل خطی (یعنی پتانسیلی که به صورت خطی با زمان افزایش یا کاهش می یابد) به الکترود کار اعمال می شود.
هنگامی که پتانسیل از پتانسیل فرمال(Eo) یک آنالیت به عقب و جلو می رود، جریانی از الکترود عبور می کند که آنالیت را اکسایش یا کاهش می دهد. بزرگی این جریان متناسب با غلظت آنالیت در محلول است که امکان استفاده از ولتامتری حلقوی را در تعیین تحلیلی غلظت میدهد.
تجهیزات مورد نیاز برای انجام ولتامتری چرخه ای شامل یک پتانسیواستات سه الکترودی معمولی است که به سه الکترود (کار، مرجع و کمکی) غوطه ور در محلول آزمایشی متصل است.
پتانسیواستات پتانسیل بین الکترود کار و مرجع را اعمال و حفظ می کند و در عین حال جریان در الکترود کار را اندازه گیری می کند. (شارژ بین الکترود کار و الکترود کمکی جریان دارد.)
یک دستگاه ثبات (مانند کامپیوتر یا پلاتر) برای ثبت ولتاموگرام حلقوی حاصل به عنوان نمودار جریان در مقابل پتانسیل استفاده می شود.
شکل 1 یک ولتاموگرام چرخه ای به دست آمده از تکنیک ولتامتری چرخه ای عمومی را نشان می دهد.
پتانسیل در امتداد محور x رسم شده و پتانسیل های مثبت تر (یا اکسید کننده) در سمت چپ و پتانسیل های منفی تر (یا کاهشی) در سمت راست نمودار نشان داده میشود.
جریان بر روی محور y ولتاموگرام رسم میشود و جریانهای کاتدی (یعنی کاهنده) در جهت مثبت و جریانهای آندی (یعنی اکسیدکننده) در جهت منفی رسم میشوند.
(ولتاموگرام تقریباً همیشه توسط الکتروشیمیدانان آمریکای شمالی به این شکل ترسیم میشود، اما در اروپا، محورها معمولاً معکوس میشوند. جهت اطلاعات بیشتر در خصوص قراردادهای رسم ولتاموگرام کلیک کنید.)
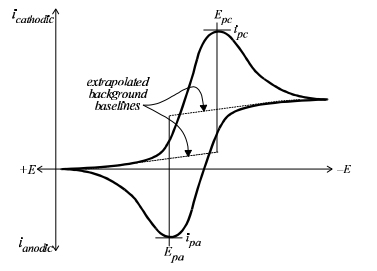
اطلاعات کمی زیادی وجود دارد که می توان از یک ولتاموگرام چرخه ای خوب به دست آورد.
-
ولتاموگرام چرخه ای آزمایشی برای بررسی برگشت پذیری زوج ردوکس می باشد.
پتانسیل پیک برای جابجایی آندی Epa و پتانسیل پیک کاتدی Epc را می توان مستقیماً از ولتاموگرام خواند و تفاوت بین آنها DEpeak را می توان محاسبه کرد.
اگر زوج ردوکس برگشت پذیر باشد، پس رابطه زیر درست است.
![]()
و n تعداد الکترون های مبادله شده است (معمولا فقط یک).
علاوه بر این، ولتاموگرام حلقوی برای یک زوج ردوکس برگشت پذیر، دارای یک جریان پیک آندی ipa برابر با جریان پیک کاتدی ipc است، به طوری که رابطه زیر نیز صادق است.
![]()
توجه به این نکته مهم است که جریان های پیک با استفاده از محور x به عنوان خط مبنا اندازه گیری نمی شوند. در عوض، یک خط جریان پسزمینه باید ابتدا به سمت پتانسیل پیک رسم شود (شکل 1 را ببینید). سپس، جریان پیک (عمودی) از پیک تا خط پس زمینه اندازه گیری می شود.
جریان پس زمینه همیشه وجود دارد، حتی در محلول آزمایشی که حاوی آنالیت الکترواکتیو نیست. این به دلیل وجود لایه دوگانه یون ها در محلول است که بلافاصله در مجاورت سطح الکترود قرار دارد.
این لایه دوگانه مانند یک خازن عمل می کند و به طور متناوب با روبش شدن پتانسیل به عقب و جلو شارژ و تخلیه می شود. بنابراین، جریان پس زمینه گاهی اوقات به عنوان جریان شارژ نامیده می شود.
پتانسیل (formal)،Eo، برای یک زوج ردوکس برگشت پذیر به عنوان میانگین دو پتانسیل پیک، به شرح زیر تعیین می شود.
![]()
پتانسیل های فرمال اندازه گیری شده با استفاده از ولتامتری چرخه ای معمولاً تا 50 میلی ولت از مقدار واقعی دقت دارند. مقادیر دقیق تری را می توان با استفاده از سایر تکنیک های الکتروشیمیایی به دست آورد.
randles-sevcik equation
تعیین ضریب انتشار و غلظت
اطلاعات کمی در مورد غلظت آنالیت را می توان از ولتاموگرام با استفاده از معادله Randles-Sevcik به دست آورد . این معادله جریان پیک ip (آندی یا کاتدی) را بر حسب غلظت آنالیت(C) مشخص می کند.
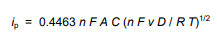
در این معادله:
-
n تعداد الکترونهایی که در نیمه واکنش برای زوج ردوکس ظاهر میشوند،
-
v سرعت جابجایی پتانسیل(V/s)،
-
F ثابت فارادی(96485 C/mol)،
-
A مساحت الکترود(cm2)،
-
R ثابت جهانی گاز(8.314 J/mol K)،
-
T دمای مطلق(K)
-
D ضریب انتشار آنالیت(cm2/sec)است.
توجه داشته باشید که اگر دما 25 درجه سانتیگراد (298.15K) فرض شود، randles-sevcik equation را می توان به شکل مختصرتری نوشت.
![]()
جایی که که ثابت واحد دارد یعنی : ( 2.687×105 C mol–1 V –1/2).
-
توجه داشته باشید که حداکثر جریان با غلظت آنالیت نسبت مستقیم دارد.
-
همچنین اگر غلظت آنالیت مقدار مشخصی باشد، می توان از ولتامتری حلقوی برای اندازه گیری ضریب انتشار آنالیت استفاده کرد. ضریب انتشار اندازه گیری سرعت حرکت آنالیت در محلول در نتیجه برخورد تصادفی با مولکول های دیگر است.
روش کار آزمایش ولتامتری چرخه ای
تمام ظروف شیشه ای مورد استفاده برای الکتروشیمی باید تا حد امکان تمیز باشند. حلال ها و معرف های مورد استفاده برای ساخت محلول ها باید تا حد امکان خالص باشند. ایده خوبی است که برای شستشوی نهایی ظروف شیشه ای و برای آماده سازی تمام محلول ها از آب دییونیزه، اولترافیلتر شده (DIUF) یا “آب رسانایی” یا “آب درجه HPLC” استفاده شود.
الف. آماده سازی محلول جهت تعیین غلظت
1) این محلول های استوک باید در اختیار یک گروه 20 نفره دانشجو قرار گیرد:
- 1M .a هیدروکلرید اسید (15 لیتر)
محلول های 1.0M هیدروکلرید اسید را می توان مستقیماً از تولیدکنندگان مواد شیمیایی تهیه نمود.
به طور متناوب، یک لیتر محلول هیدروکلرید اسید 1.0 مولار را می توان با رقیق کردن 8.0 میلی لیتر هیدروکلرید اسید غلیظ به حجم یک لیتر با استفاده از آب فوق خالص تهیه کرد. هم آب و هم اسید غلیظ باید عاری از آلودگی باشند. به یاد داشته باشید که اسید را به آب اضافه کنید.
- b. محلول استوک 250 میلی مولار کلرید آهن (2 لیتر)
این محلول را می توان با حل کردن 81.0 گرم FeCl3 در هیدروکلرید اسید 1.0 مولار برای ساخت دو لیتر محلول تهیه کرد. محلول به دست آمده غلظت آهنی نزدیک به 250 میلی مولار دارد.
توجه داشته باشید که FeCl3 کاملاً مرطوب است و وزن کردن آن به عنوان یک جامد خشک دشوار است. خرید محلول غلیظ کلرید آهن به طور مستقیم از یک تولید کننده مواد شیمیایی و سپس رقیق کردن این محلول تا غلظت 250 میلی مولار مورد نظر، بسیار ساده تر است.
- c. محلول مجهول (2 لیتر)
برای تهیه محلول مجهول کافی برای بیست (20) دانش جو، 50 تا 500 میلی لیتر از محلول ذخایر آهن را در یک فلاسک حجمی 2000 میلی لیتری پیپت کرده و با استفاده از هیدروکلرید اسید 1.0 مولار “تا خط” رقیق کنید.
به طور متناوب، مجهولات فردی را می توان با پیپت کردن 2 تا 25 میلی لیتر از محلول ذخایر آهن در بالن های 100 میلی لیتری و رقیق کردن با هیدروکلرید اسید 1.0 مولار “تا خط” تهیه کرد.
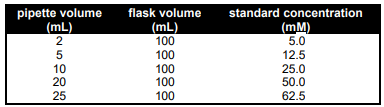
2) هر دانش جو باید پنج محلول استاندارد با غلظت های مختلف آهن از 5 تا 70 میلی مولار تهیه کند. این محلول ها را می توان با پیپت کردن حجم های مختلف محلول ذخایر آهن در 5 بالن حجمی 100 میلی لیتری تهیه کرد.
هنگام پر کردن هر بالن “تا خط”، مطمئن شوید که به جای آب از هیدروکلرید اسید 1.0M استفاده کنید.
جدول زیر به عنوان راهنمای ساخت این پنج محلول است. غلظت های ذکر شده در جدول با این فرض است که محلول استوک آهن دارای غلظت 250 میلی مولار است. دانشجویان باید این فرض را تأیید کنند و در صورت نیاز غلظتها را دوباره محاسبه کنند.
ب. نکات اولیه ولتامتری حلقوی
یک ولتاموگرام پس زمینه ساده از محلول خالص هیدروکلرید اسید 1.0 مولار راه خوبی برای تایید موارد زیر است :
-
خلوص محلول،
-
تمیزی ظروف شیشه ای
-
و آماده سازی الکترود کار صیقل داده شده
الکتروشیمیدانها اغلب قبل از رفتن به آزمایش اصلی، چنین اسکن پسزمینهای را انجام میدهند تا مطمئن شوند همه چیز درست است. هر گونه ناخالصی الکتریکی ناشی از حلال یا ظروف شیشه ای کثیف به صورت پیک های غیر قابل توضیح در اسکن پس زمینه نشان داده می شود.
علاوه بر این، سطح الکترود آلوده یا نادرست صیقل داده شده، معمولاً جریان پس زمینه بزرگتری ایجاد می کند. با این حال، توجه داشته باشید که حتی الکترودهای پلاتین تمیز نیز به دلیل رسوب اکسید و عاری سازی، پیک هایی از خود نشان می دهند.
برای سرعت رفت و برگشت 100 میلی ولت بر ثانیه، بزرگی جریان پس زمینه نباید از 300 میلی آمپر بر سانتی متر مربع تجاوز کند (یعنی 300 برابر مساحت الکترود بر حسب سانتی متر مربع).
اگر پیک های قابل توجهی (به غیر از اکسیدرسوب و پیک های جداسازی) آشکار شود، ظروف شیشه ای، سطح الکترود و/یا حلال آلوده هستند. اگر جریان پس زمینه خیلی زیاد باشد، الکترود باید جلا داده شود.
اگر محدودیت های روبش به پتانسیل های شدیدتر گسترش یابد، جریان های پس زمینه نسبتاً بزرگی مشاهده می شود. در پتانسیل های بسیار مثبت، حلال (آب) شروع به اکسید شدن در الکترود می کند و در پتانسیل منفی، یون هیدرونیوم به گاز هیدروژن کاهش می یابد.
3) یک الکترود کار دیسک پلاتینیومی تهیه کنید.
حتما سطح دیسک را به سانتی متر مربع در دفترچه یادداشت آزمایشگاهی خود یادداشت کنید. الکترود را در صورت نیاز با استفاده از دوغاب آلومینا بر روی یک پارچه پولیش جلا دهید. پس از پرداخت، الکترود را با آب فوق خالص بشویید و پاک کنید. سطح الکترود باید آینه ای و بدون نقص باشد.
4) یک سلول الکتروشیمیایی تمیز را به یک الکترود مرجع SCE و یک الکترود کمکی پلاتین مجهز کنید. الکترود کار پلاتین را نیز به دقت در سلول نصب کنید.
5) سلول الکتروشیمیایی را با محلول هیدروکلریداسید خالص 1.0M پر کنید. در صورت تمایل، اکسیژن موجود در سلول را می توان با حباب زدن نیتروژن در محلول به مدت یک یا دو دقیقه، پاکسازی کرد. حتی اگر تداخل اکسیژن با سیستم شیمیایی مورد مطالعه در این آزمایش بعید باشد، حذف اکسیژن از یک سلول الکتروشیمیایی همچنان یک روش عمومی خوب است..
6) پتانسیواستات شرکت بهپژوه را روشن کنید و تمام اتصالات الکتریکی لازم بین الکترودها و پتانسیواستات را برقرار کنید و سپس نرم افزار Behpajooh Software را اجرا کنید.
از قسمت:
port setting-->load--->port name
اتصال را انتخاب کرده سپس setرا زده و وارد پنل نرم افزار شوید.سپس اسکن اولیه را انجام دهید.
ج. تعیین غلظت
در این بخش از آزمایش، چندین ولتاموگرام حلقوی با محلول هایی با غلظت های متفاوت به دست می آید. حداقل پنج محلول استاندارد، با غلظت آهن (III) در محدوده 5 تا 70 میلی مولار، باید استفاده شود. استانداردها باید با استفاده از محلول 1.0M هیدروکلریداسید به عنوان حلال تهیه شوند.
7) یک سلول الکتروشیمیایی تمیز را به یک الکترود مرجع SCE و یک الکترود کمکی پلاتین مجهز کنید. الکترود کار پلاتین را نیز به دقت در سلول نصب کنید.
8) سلول الکتروشیمیایی را با محلول استانداردی که کمترین غلظت آهن را دارد پر کنید. مطمئن شوید که هر سه الکترود در محلول غوطه ور هستند. در صورت تمایل، اکسیژن موجود در سلول را می توان با حباب زدن نیتروژن در محلول به مدت یک یا دو دقیقه پاکسازی کرد.
9) بعد از اینکه سلول به درستی پیکربندی شد، از پانل techniques ، تکنیک Cyclic voltammetry (ولتامتری چرخه ای) را انتخاب کنید. و تنظیمات را مطابق شکل 2 وارد کنید.
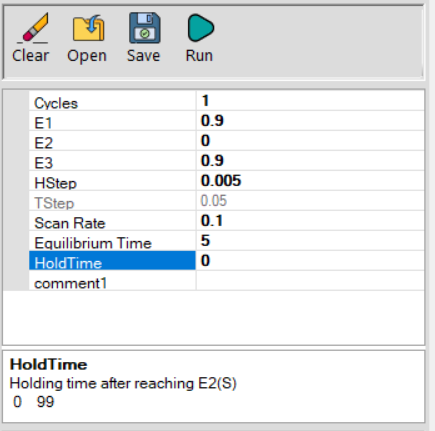
10) حساسیت جریان مشاهده شده ممکن است نیاز به تغییر داشته باشد(پنل Select Step).
(بزرگترین جریانی که باید در طول آزمایش مشاهده شود را می توان تقریباً با ضرب سطح الکترود در غلظت محلول و مقدار 450 mA M –1 cm–2 میلی آمپر تخمین زد.)
11) هنگامی که تنظیمات آزمایش مطابق با شکل 2 تنظیم شد، روی دکمه Run کلیک کنید تا آزمایش شروع شود. یک موج کاتدی نسبتاً برجسته باید در حین حرکت از 900+ میلی ولت تا صفر میلی ولت ظاهر شود. در حرکت برگشت، یک موج آندی با اندازه مساوی باید ظاهر شود.
12) پس از به دست آوردن یک ولتاموگرام رضایت بخش، آن را ذخیره کنید.
13) با انتخاب گزینه Show Results and Analyse از پنل سمت چپ ولتاموگرام را به صورت نمودار جریان در مقابل زمان مشاهده کنید. سپس از ابزار Peak Search که در انتهای منوی بالایی یافت می شود برای اندازه گیری ارتفاع پیک کاتدی استفاده کنید. توجه داشته باشید که قله کاتدی اولین پیک است و در نمودار I1 در مقابل V به سمت پایین اشاره می کند.
14) ولتاموگرام های مشابهی را برای محلول های استاندارد باقی مانده به ترتیب افزایش غلظت آهن (III) بدست آورید. برای همه محلول ها از سرعت روبش کردن یکسان (100 میلی ولت بر ثانیه) استفاده کنید. سل را بین آزمایش ها تمیز کنید.
15) پس از مطالعه آخرین محلول استاندارد، آن را در سلول بگذارید و برای قسمت بعدی آزمایش از آن استفاده کنید.
د. اثر روبش در ولتامتری حلقوی
با استفاده از محلول آهن استاندارد با بالاترین غلظت آهن (III)، باید یک سری ولتاموگرام حلقوی با سرعتهای مختلف جابجایی بدست آید. حداکثر جریان مشاهده شده در این ولتاموگرام ها باید وابستگی قابل توجهی به نرخ روبش نشان دهد.
16) با استفاده از پارامترهای مشابه با پارامترهای شکل 2، ولتاموگرام ها را با نرخ های روبش زیر بدست آورید:
- 225،
- 170،
- 120،
- 80
- 50 میلی ولت بر ثانیه.
مطمئن شوید که هر ولتاموگرام را ذخیره کنید. علاوه بر این، از ابزار Peak Search برای اندازه گیری ارتفاع پیک کاتدی از هر ولتاموگرام استفاده کنید.
ه. محلول مجهول
مربی ممکن است محلولی ارائه دهد که غلظت آهن (III) نامشخصی دارد. این محلول باید با استفاده از همان سرعت روبشی که برای بررسی سری محلول های استاندارد آهن (III) (mV/s 100) استفاده می شود، بررسی شود.
اگر محلول مجهول غلظتی برابر با استانداردهای شما داشته باشد، ممکن است مستقیماً مطابق با روش ارائه شده توسط مربی بررسی شود. اگر غلظت مجهول آهن (III) بسیار بیشتر از غلظت استاندارد شما باشد، محلول مجهول ابتدا باید با غلظت کمتری رقیق شود.
17) با استفاده از پارامترهای روبشی مشابه با پارامترهای شکل 2، یک ولتاموگرام از محلول آهن ناشناخته را با استفاده از نرخ روبش 100 mV/s بدست آورید. مطمئن شوید که ولتاموگرام را ذخیره کنید.
علاوه بر این، از ابزار Peak Search برای اندازه گیری ارتفاع پیک کاتدی در ولتاموگرام استفاده کنید. توجه داشته باشید که حساسیت الکترود ممکن است به مقداری متفاوت از مقدار نشان داده شده در شکل 2 تنظیم شود.
تعیین غلظت آهن
آنالیز ولتامتری چرخه ای
a) با استفاده از جریان های پیک کاتدی برای مجموعه ای از محلول های استاندارد، نموداری از جریان پیک در مقابل غلظت تهیه کنید. (مطمئن شوید که هر یک از ولتاموگرام ها با استفاده از نرخ جابجایی یکسان به دست آمده اند.)
b) تجزیه و تحلیل حداقل مربعات خطی را روی داده ها انجام دهید تا معادله بهترین خط مستقیم را که با داده ها مطابقت دارد پیدا کنید.
c) از شیب خط برای محاسبه ضریب انتشار برای کاتیون آهن (III) در هیدروکلیرد اسید 1.0M استفاده کنید.
محلول مجهول آهن
d) با استفاده از معادله (b)، بالا، غلظت آهن (III) را در محلول مجهول محاسبه کنید. نتیجه خود را بر حسب مول بر لیتر با استفاده از سه رقم قابل توجه گزارش دهید.
مطالعه سرعت روبش ولتامتری چرخه ای
e) با استفاده از جریانهای پیک کاتدی اندازهگیری شده از سری ولتاموگرامهای بهدستآمده در نرخهای جابجایی مختلف از تکنیک ولتامتری چرخه ای، نموداری از جریان پیک در مقابل جذر سرعت جابجایی را تهیه کنید. (مطمئن شوید که هر یک از ولتاموگرام ها با استفاده از یک محلول استاندارد به دست آمده اند.)
f) یک تحلیل حداقل مربعات خطی روی داده ها انجام دهید تا معادله بهترین خط مستقیم را که با داده ها مطابقت دارد پیدا کنید.
g) از شیب خط برای محاسبه ضریب انتشار برای کاتیون آهن (III) در هیدروکلیرد اسید 1.0M استفاده کنید.
h) با استفاده از ولتاموگرام بهدستآمده با استفاده از کندترین سرعت روبش، پتانسیل فرمال،Eo را برای زوج ردوکس آهن (III/II) تعیین کنید. نتیجه را بر حسب ولت در مقابل الکترود هیدروژن استاندارد (SHE) بیان کنید و آن را با مقدار پذیرفته شده از کتاب مرجع مقایسه کنید.
سؤالات گزارش ولتامتری چرخه ای
1) توضیح دهید، با توجه به آنچه در لایه انتشار بلافاصله در مجاورت سطح الکترود اتفاق می افتد، چرا سرعت جابجایی سریع تر جریان های پیک بالاتری می دهد؟
2) جریان های مشاهده شده در(Eo) را برای هر یک از محلول های استاندارد و برای اسکن پس زمینه بررسی کنید. سپس یک تخمین تقریبی از غلظت های زیر ارائه دهید:
- الف) جریان کاتدی در چه غلظتی ده برابر جریان شارژ است؟ این غلظت به عنوان حد کمیت (LOQ) تعریف می شود.
- ب) جریان کاتدی در چه غلظتی سه برابر جریان شارژ است؟ این غلظت به عنوان حد تشخیص (LOD) تعریف می شود.
3) هنگامی که گروهی از مولکول ها یا یون ها به طور تصادفی در یک محلول پخش می شوند، میانگین فاصله x، که آنها در یک دوره زمانی حرکت می کنند، می تواند با استفاده از x =(2 D t) 1/2 تخمین زده شود، جایی که D ضریب انتشار است.
با استفاده از نتیجه آزمایشی خود برای ضریب انتشار آهن (III)، نشان دهید که بیش از یک روز طول میکشد تا گروهی از کاتیونهای آهن (III) فقط یک سانتیمتر منتشر شوند.
سوالات قبل از آزمایش تعین غلظت آهن مجهول
قبل از شروع آزمایش به سوالات زیر پاسخ دهید.
1) در روش آزمایش، الکترود عمداً به سمت پتانسیل های مثبت و منفی شدید هدایت می شود. جریان های بزرگ به دلیل کاهش یون هیدرونیوم یا اکسیداسیون آب جریان می یابد. نیمه واکنش را برای هر یک از این دو فرآیند بنویسید و پتانسیل الکترود کاری مورد نیاز برای شروع هر فرآیند را تخمین بزنید.
2) در بخش C(ج) از روش آزمایشگاهی بالا، به شما توصیه می شود که محلول های استاندارد را به ترتیب افزایش غلظت بررسی کنید. چرا انجام این کار ایده خوبی است؟
3) محلول استاندارد 4.500 میلی مولار از یک آنالیت با استفاده از ولتامتری حلقوی در دمای 25.0 درجه سانتیگراد تهیه و مورد مطالعه قرار می گیرد.
- یک الکترود دیسک پلاتین با قطر 5.0 میلی متر استفاده می شود.
- آنالیت یک جفت ردوکس ساده یک الکترون (n = 1) را نشان میدهد و دارای ضریب انتشار، D، برابر با 7.56×10-5 cm2 /s است.
- سرعت رفت و برگشت 200.0 میلی ولت بر ثانیه است.
با استفاده از معادله Randles-Sevcik (معادل 1.4)، حداکثر جریانی که باید مشاهده شود را محاسبه کنید.
یادداشت
زوج ردوکس آهن (III/II) (در محلول اسیدی) یکی از خوش رفتارترین و برگشت پذیرترین زوج های ردوکس موجود برای اهداف آموزشی است.
الکتروشیمی بیشتر کاتیونهای فلزی دیگر با واکنشهای تشکیل اکسید، آبکاری روی سطح الکترود، یا پتانسیلهای فرمال بسیار شدید که در محلول آبی قابل مشاهده نیست، پیچیده است.
کلرید آهن (III) به عنوان آنالیت انتخاب شد زیرا به طور گسترده در دسترس و ارزان است. سایر سیستمهای برگشتپذیر و با رفتار خوب که میتوان آنها را بررسی کرد در زیر فهرست شدهاند:
تهیه محلول استاندارد
تهیه یک محلول استاندارد شده از کلرید آهن (III) به دلیل این واقعیت که نمک کاملاً رطوبت گیر است، پیچیده است.
نمک باید به سرعت وزن شود تا از خطاهای ناشی از جذب آب از هوا جلوگیری شود. همچنین تقریباً روی هر سطحی که با آن تماس می گیرد، لکه های قهوه ای نامطلوب بر جای می گذارد. به همین دلیل، خرید محلول استوک از یک تولید کننده مواد شیمیایی ایده خوبی است.
محلول های حاوی آهن (III) به عنوان استانداردهای جذب اتمی و سایر آنالیزهای شیمیایی مرطوب فروخته می شوند. محلول “غلیظ” کلرید آهن (III) از یک سازنده مواد شیمیایی معمولاً 40٪ (w/v) کلرید آهن (III) است.
اگر این محلول با ضریب ده رقیق شود (البته با استفاده از اسید کلریدریک 1.0M) غلظت آهن (III) نزدیک به 0.25M خواهد داشت که برای محلول ذخیره در این آزمایش لازم است. برای نتایج دقیق، چنین راه حلی باید استاندارد شود.
با این حال، اگر همه دانشآموزان از محلول موجودی یکسان استفاده کنند و مجهول نیز از آن تهیه شود، تا زمانی که به دانشآموزان مقدار معقولی برای غلظت محلول موجود داده شود، میتوان از استانداردسازی صرف نظر کرد.
این ممکن است باعث ایجاد خطا در محاسبات ضریب انتشار شود، اما هنوز هم میتوان تعیینهای ناشناخته را کاملاً درجهبندی کرد، زیرا همه (از جمله مربی) از محلول موجودی یکسان استفاده کردند.
مقادیر پذیرفته شده در اسید پرکلریک 1 مولار و اسید سولفوریک 1 مولار، مقادیر به ترتیب 4.7×10-6 cm2 /sec و 3.0×10-6 cm2 /sec هستند. مقدار کمتر در اسید سولفوریک به کمپلکس شدن با آنیون سولفات نسبت داده می شود.
دانش جویان باید مقدار خود را با استفاده از جریان های اوج برای کاهش آهن (III) به آهن (II) محاسبه کنند. دانش آموزان هنگام تعیین ضریب انتشار معمولاً اشتباهات محاسباتی زیادی مرتکب می شوند. تجزیه و تحلیل واحد به ویژه برای آنها دشوار است.
از دانشآموزان خواسته میشود پتانسیل فرمال،Eo را برای زوج ردوکس آهن (III/II) اندازهگیری کنند، که مقدار پذیرفتهشده 0.700 V در مقابل SHE است.
پتانسیل های فرمال تعیین شده با استفاده از ولتامتری چرخه ای در حدود 50 میلی ولت خوب است. مقاومت بیش از حد محلول یا گرفتگی شیشه در انتهای الکترود مرجع می تواند باعث خطاهای اندازه گیری قابل توجهی شود. (مرجع SCE در 0.2444+ ولت در مقابل SHE است.)
یک توسعه جالب برای این آزمایش استفاده از طیف سنجی برای تعیین غلظت مجهول است. این به دانش آموزان اجازه می دهد تا مقایسه مستقیمی بین دو تکنیک تحلیلی بسیار متفاوت انجام دهند.
برای انجام این روش اضافی، محلول های استاندارد (و ناشناخته) مورد استفاده در این آزمایش، که غلظت آنها در محدوده 5 تا 70 میلی مولار است، باید حداقل با ضریب 100 رقیق شوند. پس از این رقت، محلول ها باید جذب شوند.
خوانش در محدوده 0.2 تا 2.0 با استفاده از کووت های 1.0 سانتی متری انجام میشود. رقت ها را می توان با استفاده از آب یا اسید هیدروکلریک 1.0 مولار به عنوان حلال انجام داد.
- پاسخ به سوالات قبل از آزمایش تعین غلظت آهن مجهول
سوال 1
در حد پتانسیل منفی (کاتدی)، یون های هیدرونیوم بر اساس نیمه واکنش زیر به گاز هیدروژن تبدیل می شوند:
![]()
در حد پتانسیل مثبت (آندی)، آب به شرح زیر به گاز اکسیژن اکسید می شود:
![]()
توجه داشته باشید که هر یک از واکنشهای بالا را میتوان با استفاده از H+برای نشان دادن یون هیدرونیوم نوشت تا زمانی که تعداد مناسبی از مولکولهای آب از هر دو سمت چپ و راست معادلات متعادل حذف شوند.
سوال 2
دلیل بررسی محلول های استاندارد به ترتیب افزایش غلظت (در هر روش تحلیلی) به حداقل رساندن آلودگی یک محلول استاندارد با محلول دیگر است.
اگر محلول جدیدی به سلول الکتروشیمیایی اضافه شود که به طور ناخواسته حاوی مقداری از محلول قبلی است، در صورتی که محلول قبلی غلظت آهن (III) کمتری داشته باشد، میزان آلودگی کمتر است.
سوال 3
نکته اصلی در اینجا توجه دقیق به تحلیل واحد است. شکل کلی معادله Randles-Sevcik در زیر آورده شده است:

- پاسخ به سوالات گزارش ولتامتری چرخه ای
سوال 1
سرعت جابجایی سریعتر، شیب غلظت تندتری را در سطح الکترود ایجاد میکند که باعث جریانهای پیک بزرگتر میشود. راه دیگری برای بررسی این موضوع این است که سرعت اسکن سریعتر باعث می شود که همان مقدار شارژ در مدت زمان کوتاه تری عبور کند. از آنجایی که جریان نسبت شارژ به زمان است، سرعت جابجایی سریعتر جریان بزرگتری میدهد.
سوال 2
کمترین غلظت آهن (III) قابل تشخیص (با استفاده از سرعت جاروب 100 mV/sec) حدود 0.4 میلی مولار است و به خلوص حلال بستگی دارد.
سوال 3
با استفاده از مقدار پذیرفته شده برای ضریب انتشار کاتیون آهن (III)، گروهی از این کاتیون ها تنها 9.0 میلی متر در یک روز پخش می شوند. البته نتایج دانش آموز متفاوت خواهد بود.
———-
آزمایش دوم تعیین استامینوفن در اکسیر تسکین درد کودکان است.
- این آزمایش از ولتامتری چرخه ای برای تعیین مقدار ماده فعال در یک داروی بدون نسخه استفاده و دانش آموزان را با استفاده از الکترود کربن و یک زوج ردوکس غیرقابل برگشت آشنا می کند.
آزمایش سوم، بررسی سه روش ولتامتری است.
- این آزمایش دانشآموزان را با کرونوآمپرومتری و ولتامتری دیسک چرخان آشنا میکند و بر دانش قبلی آنها از ولتامتری چرخهای استوار میشود. بدیهی است که برای تکمیل این آزمایش باید یک الکترود دیسک چرخان در دسترس باشد. هدف این آزمایش مشاهده این است که چگونه پاسخهای سه روش مختلف ولتامتری توسط انتشار فیزیکی کنترل میشوند.
(جهت مطالعه گزارش کار آزمایشگاه شیمی تجزیه 2 :بررسی سه روش ولتامتری کلیک کنید.)
(جهت مطالعه تجهیزات لازم برای آزمایشگاه الکتروشیمی کلیک کنید.)
(جهت مطالعه دستور کار آزمایشگاه الکتروشیمی (مقدمه)، کلیک کنید.)
References
Educator’s Reference Guide for Electrochemistry
1) R.N. Adams, Electrochemistry at Solid Electrodes (Marcel Dekker: NewYork, 1969) ch. 8.
2) A.J. Bard, L.R. Faulkner, Electrochemical Methods: Fundamentals and Applications (John Wiley & Sons: New York, 1980) ch.6.

1 نظر
به گفتگو بپوندید و نظر خود را به ما بگویید.
First of all I would like to say excellent blog!
I had a quick question which I’d like to ask if you don’t mind.
I was interested to find out how you center yourself and
clear your thoughts before writing. I’ve had trouble clearing my thoughts in getting
my thoughts out there. I do enjoy writing however it just seems like the first 10 to 15 minutes are wasted simply just trying to
figure out how to begin. Any suggestions or tips?
Thanks!