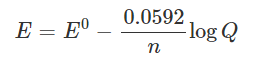بررسی معادله نرنست؛ سل دو الکترودی وسه الکترودی
در این مقاله توضیحاتی در خصوص معادله نرنست،سل دو و سه الکترودی، الکترود کار،کمکی و رفرنس داده خواهد شد.
معادله نرنست
مانند تمام واکنشهای الکتروشیمیایی برگشتپذیر، واکنش های الکترود مرجع را می توان با معادله 1 توصیف کرد.
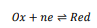
که در آن 𝑂x و 𝑅ed به ترتیب گونه های اکسید شده و احیا شده را توصیف می کنند و 𝑛 نشان دهنده تعداد الکترون های عبور داده شده در طول واکنش الکتروشیمیایی است.
رابطه نرنست
وقتی 𝑂x و 𝑅ed در حالت تعادل هستند، پتانسیل تعادل واکنش الکتروشیمیایی برگشت پذیر را می توان با معادله نرنست توصیف کرد (معادله 2)،
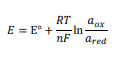
که پارامترها در معادله نرنست به شرح زیر است:
- 𝐸 پتانسیل اندازه گیری شده ،
- 𝐸0 پتانسیل کاهش استاندارد برای واکنش مورد نظر،
- 𝑅 ثابت جهانی گاز ،
- 𝑇 دما،
- 𝑛 فعالیت گونه اکسید شده در واکنش مورد نظر،
-
𝐹 در معادله نرنست ثابت فارادی،
- 𝑎𝑂x فعالیت گونه اکسیدشده
- 𝑎𝑅ed فعالیت گونه کاهش یافته
ارتباط فعالیت و غلظت گونه با ضریب فعالیت
فعالیت یا اکتیویته یک گونه به عنوان مثال 𝑎𝑂x ، رابطه بین غلظت آن گونه ([𝑂x]) و ضریب فعالیت (𝛾𝑜x) را توصیف می کند (معادله 3).
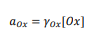
ضریب فعالیت رفتار غیر ایده آل را در مخلوط 𝑂x در سراسر سلول الکتروشیمیایی نشان می دهد.
فرمول نرنست برحسب غلظت
اگر غلظتها جایگزین فعالیت شوند، شکل آشناتری از معادله نرنست پدیدار میشود (نگاه معادله 4)، که در آن ‘°E پتانسیل فرمال الکترود است (معادله 5).
![[Red]/[OX]E=E0+RT/nF ln](https://www.behpajooh.net/wp-content/uploads/2017/10/۴.png)
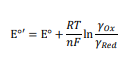
پتانسیل نرنست
از آنجایی که تمام الکترودهای مرجع در حالت تعادل کار می کنند، در نتیجه پتانسیل تعادل آنها را می توان با معادله نرنست توصیف کرد (معادله 4).
معادله nernst در 25 c
در دمای 25 درجه سانتیگراد با جایگذاری مقادیر RT/F در معادله نرنست و بیان کردن بر حسب لگاریتم، قضیه نرنست بر حسب لگاریتم خارج قسمت واکنش به شکل زیر است.
-
معادله نرنست در 25 درجه Q ضریب واکنش ترمودینامیکی معادله شیمیایی موازنه
مثال معادله نرنست
الکترود مرجع معروف نقره/کلرید نقره را در نظر بگیرید. واکنش نقره کلرید شامل اضافه شدن یک الکترون به نقره کلرید جامد برای تولید برگشت پذیر نقره جامد و یون کلرید آبی است (معادله 6).
از معادله نرست برای محاسبه پتانسیل تعادل الکترود استفاده می شود (به میلی ولت، به معادله 7 مراجعه کنید)، اما از آنجایی که غلظت اجزای جامد تغییر نمی کند، پتانسیل تعادل به غلظت یون کلرید وابسته است (نگاه کنید به: معادله 8)
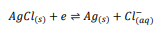
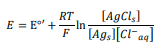
![[Cl-]E=E0'-RT/F ln](https://www.behpajooh.net/wp-content/uploads/2017/10/۸.png)
اندازهگیری پتانسیل الکترود استاندارد در یک سلول دو الکترودی
برای اینکه واکنش الکترودی در یک سلول الکتروشیمیایی رخ دهد، باید حداقل دو الکترود وجود داشته باشد.
الکترود کار: انتقال الکترون را به آنالیت مورد نظر تسهیل می کند
الکترود کمکی: با شرکت در واکنشی با علامت مخالف، خنثی بودن الکترون را حفظ می کند.
اگرچه اندازه گیری پتانسیل مطلق هر الکترود با قطعیت امکان پذیر نیست، ولتاژ سلول را می توان با اندازه گیری اختلاف پتانسیل بین دو الکترود تعیین کرد.
دلایل لزوم وجود الکترود مرجع
- همانطور که ولتاژ به الکترود کار اعمال می شود یک لایه دوگانه الکتریکی در رابط الکترود/محلول روی هر دو الکترود وارد می شود که باعث تغییرات پتانسیل و تغییر کلی در سرعت فرآیندهای فارادایی در هر سطح الکترود می شود. در نتیجه، سرعت تغییر پتانسیل در هر الکترود غیرقابل پیشبینی است و کنترل دقیق پتانسیل الکترود کار را دشوار میکند.
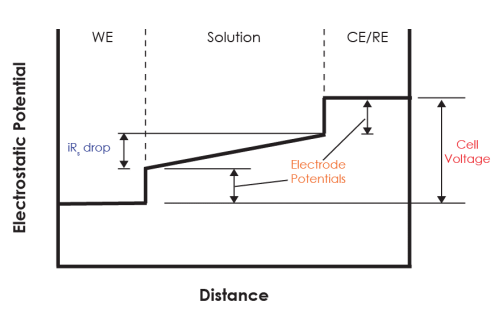
- علاوه بر این، به دلیل وجود مقاومت محلول،𝑅𝑠، افت ولتاژ (V=iRs) در سراسر محلول مشاهده می شود (نگاه کنید به: شکل 1)، که خطای بیشتر در اندازه گیری ولتاژ سلول ایجاد میکند.
در نتیجه، برای تعیین دقیق ولتاژ سلول:
افت اهمی باید ناچیز باشد و یکی از الکترودها باید پتانسیل تزلزل ناپذیری داشته باشد.
از آنجایی که قرار است پتانسیل الکترود کار نسبت به الکترود شمارنده تغییر کند، یک سیستم نیمه سلولی برای الکترود شمارنده ایجاد می شود که در آن اجزای درون آن در غلظت بالایی قرار دارند و به الکترود شمارنده اجازه میدهد عملاً تحت تأثیر جریان قرار نگیرد و پتانسیل آن ثابت بماند. الکترود شمارنده از این نوع الکترود مرجع نامیده می شود.
از آنجایی که پتانسیل الکترود مرجع تغییر نمی کند، هر تغییر ولتاژ اعمال شده بین الکترود کار و الکترود مرجع به الکترود کار نسبت داده می شود (تا زمانی که افت اهمی ناچیز باشد).
اندازه گیری پتانسیل الکترود استاندارد در یک سلول سه الکترودی
به ساده ترین مفهوم، یک الکترود مرجع که به عنوان یک الکترود کمکی نیز عمل می کند (یعنی الکترود مرجع در سلول دو الکترودی) دارای دو مسئله ذاتی است:
-
در آزمایش های جریان بالا مانند الکترولیزحجیم یا تکنیک های ولتامتری سریع، تغییر غلظت القایی در الکترود مرجع دیگر قابل چشم پوشی نیست و پتانسیل الکترود را تغییر می دهد (به بخش3 مراجعه کنید).
-
برای سیستم های غیر آبی، اغلب حذف کامل افت اهمی دشوار است. ورود الکترود سوم به سلول الکتروشیمیایی به راحتی مشکل اول را کاهش می دهد.
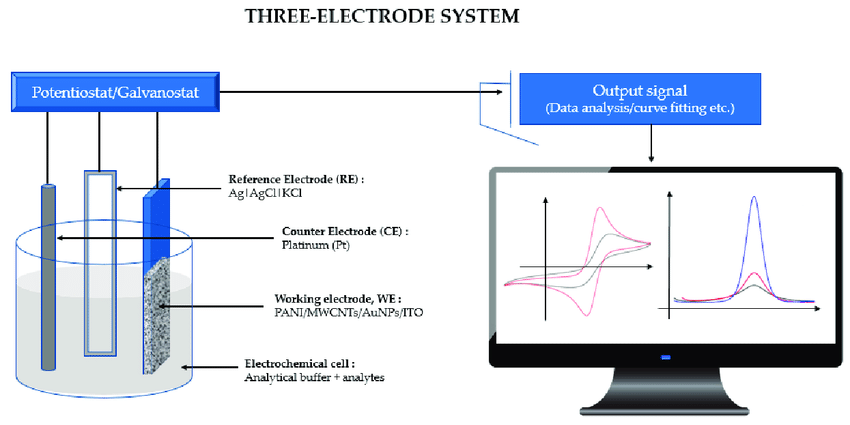
دلیل استفاده از الکترود کمکی
در یک سلول سه الکترودی، مدار الکترونیکی با یک مقاومت ورودی بالا بین الکترودهای کار و مرجع اصلاح می شود. در نتیجه جریان بسیار کمی بین الکترودهای کار و مرجع جریان می یابد و پتانسیل الکترود مرجع بدون تغییر باقی می ماند.
الکترود سوم که معمولاً الکترود کمکی یا الکترود شمارنده نامیده می شود، برای خنثی نگه داشتن بار الکتریکی سلول عمل میکند. الکترود کمکی اغلب در یک محفظه جداگانه با استفاده از فریت قرار می گیرد تا اطمینان حاصل شود که هر گونه الکترواکتیو تولید شده به الکترود کار نمی رسد و فرآیند مورد نظر را تغییر نمی دهد.
رفع مشکل خطای افت اهمی
رفع مشکل دوم، خطای افت اهمی، دشوارتر است. از آنجایی که الکترود مرجع برای حفظ خنثی بودن الکتریکی در سلول سه الکترودی عمل نمی کند، می توان مرجع را نزدیک تر به الکترود کار قرار داد تا افت اهمی بین آنها کاهش یابد. هرچند اینکار به طور کامل خطای افت اهمی را کاهش نمی دهد، اما کمک قابل توجهی خواهد کرد. راه های دیگر برای کاهش افت اهمی شامل استفاده از یک الکترود کوچکتر کار برای کاهش مقدار جریان عبوری و افزایش رسانایی محلول است.
- اطلاعات: اگر الکترودهای کار و مرجع خیلی نزدیک به هم قرار گیرند، نوساناتی رخ می دهد. اگر در ولتاموگرام نوسانات مشاهده شد، به آرامی الکترودها را از هم جدا کنید تا نوسانی دیده نشود.
جهت مطالعه مقاله الکترودهای مرجع غیر آبی کلیک کنید.
- جهت مطالعه متن لاتین کلیک کنید.